��Ŀ����
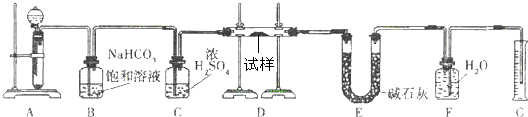
����һ��������Na2O���ʵ�Na2O2����������ͼ��ʵ��װ�òⶨNa2O2�����Ĵ��ȣ����ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6mol/L���ᡢ6mol/L���������ˮ��

�ش��������⣺
��1��װ��A��Һ���Լ�ѡ��
��2��װ��B��������
��3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��
��4������ʼʱ�����Ʒ������Ϊ2.0g����Ӧ���������������Ϊ224mL����״��������Na2O2�����Ĵ���Ϊ

�ش��������⣺
��1��װ��A��Һ���Լ�ѡ��
6mol/L����
6mol/L����
�������������̼��Ʒ�Ӧ���ɵ������������ˮ�ģ��Ḳ����̼��Ƶı��棬ʹ��Ӧ���ܳ���
�����̼��Ʒ�Ӧ���ɵ������������ˮ�ģ��Ḳ����̼��Ƶı��棬ʹ��Ӧ���ܳ���
����2��װ��B��������
��ȥ�����е�HCl
��ȥ�����е�HCl
��װ��C����������������
��������
��װ��E�м�ʯ�ҵ�����������װ��D�з�Ӧʣ��Ķ�����̼
����װ��D�з�Ӧʣ��Ķ�����̼
����3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��
2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3
����4������ʼʱ�����Ʒ������Ϊ2.0g����Ӧ���������������Ϊ224mL����״��������Na2O2�����Ĵ���Ϊ
78%
78%
����������1������ʵ��ԭ��װ��A���õ���̼��ƺ����ᷴӦ���ɶ�����̼������̼��ƺ����ᷴӦ��������ش�
��2����õĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ���ʯ�ҿ������ն�����̼��
��3�����������ƺ������Ƶ��������ش�
��4�������������������������Ĺ�ϵ����ù���������������������������ƵĴ��ȣ�
��2����õĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ���ʯ�ҿ������ն�����̼��
��3�����������ƺ������Ƶ��������ش�
��4�������������������������Ĺ�ϵ����ù���������������������������ƵĴ��ȣ�
����⣺��1��װ��A��̼��ƺ����ᷴӦ���ɶ�����̼��̼��ƺ����ᷴӦʱ�����ɵ������������ˮ�ģ��Ḳ����̼��Ƶı��棬ʹ��Ӧ���ܳ����������������������������Ӧ��
�ʴ�Ϊ��6mol/L���ᣬ�����̼��Ʒ�Ӧ���ɵ������������ˮ�ģ��Ḳ����̼��Ƶı��棬ʹ��Ӧ���ܳ�����
��2��̼��ƺ����ᷴӦ���ɵĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ����Խ�������̼���װ��E�м�ʯ�ҵ����������ն�����̼����ֹ�����������������ɸ��ţ�
�ʴ�Ϊ����ȥ�����е�HCl���������壻����װ��D�з�Ӧʣ��Ķ�����̼��
��3�������ƺ������ƺͶ�����̼��Ӧ��ԭ������ʽ�ֱ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3��
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3��
��4�����ݷ�Ӧ2Na2O2+2CO2=2Na2CO3+O2����Ӧ���������������Ϊ224mL����״�����������ɵ���������0.01mol���������Ƶ����ʵ���Ϊ0.02mol��
�������ƵĴ���=
��100%=78%���ʴ�Ϊ��78%��
�ʴ�Ϊ��6mol/L���ᣬ�����̼��Ʒ�Ӧ���ɵ������������ˮ�ģ��Ḳ����̼��Ƶı��棬ʹ��Ӧ���ܳ�����
��2��̼��ƺ����ᷴӦ���ɵĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ����Խ�������̼���װ��E�м�ʯ�ҵ����������ն�����̼����ֹ�����������������ɸ��ţ�
�ʴ�Ϊ����ȥ�����е�HCl���������壻����װ��D�з�Ӧʣ��Ķ�����̼��
��3�������ƺ������ƺͶ�����̼��Ӧ��ԭ������ʽ�ֱ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3��
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��Na2O+CO2=Na2CO3��
��4�����ݷ�Ӧ2Na2O2+2CO2=2Na2CO3+O2����Ӧ���������������Ϊ224mL����״�����������ɵ���������0.01mol���������Ƶ����ʵ���Ϊ0.02mol��
�������ƵĴ���=
| 0.02mol��78g/mol |
| 2.0g |
���������⿼��ѧ���������ƵĻ�ѧ����֪ʶ��ͨ��ʵ�鷽ʽ�����������Ѷȣ��ۺ��Խ�ǿ��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ