题目内容
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程 中放出的热量可计算中和热。回答下列问题: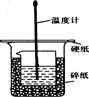
(1)烧杯间填满碎纸条的作用是 。
(2)从实验装置上看,图中缺少的仪器是 。
(3)实验中若用70mL0.50mol·L-1盐酸跟70mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”“偏小”或“无影响”)。
(1)隔热保温;(2)环形玻璃搅拌器;(3)不相等;相等;(4)偏小
解析试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;(2)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;(3)若用70mL0.50mol·L-1盐酸跟70mL0.55mol·L-1NaOH溶液,则生成水的物质的量大于0.025mol,故放出的热量不相等,但中和热指的是酸碱中和反应生成1mol水时所放出的热量,故中和热值是相等的,答案为不相等;相等;(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,求得的中和热数值将会减小,故答案为:偏小.
考点:中和热的测定

下列物质中,既能和盐酸反应,又能和氢氧化钠反应的物质是
| A.碳酸钠 | B.碳酸氢钠 | C.氯化钠 | D.硫酸铜 |
下列有关用途的说法中,错误的是
| A.液态钠可用作核反应堆的传热介质 | B.在过渡元素中寻找半导体材料 |
| C.考古时利用l4C测定一些文物的年代 | D.235U是一种重要核燃料 |
下列物质含有离子键的是
| A.Br2 | B.CO2 | C.NaBr | D.H2O |
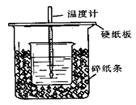
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时用环形玻璃棒搅拌溶液的方法是_______________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是__________________________。
在相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.电离度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
下列物质中,其产量可以用来衡量一个国家石油化工发展水平的是
| A.甲烷 | B.乙烯 | C.汽油 | D.乙醇 |
 2NH3 (g) 达到平衡状态标志的是
2NH3 (g) 达到平衡状态标志的是