题目内容
【题目】如图所示为工业合成氨的流程图。有关说法不正确的是( )
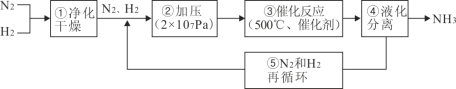
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.产品液氨除可生产化肥外,还可用作制冷剂
D.步骤③、④、⑤均有利于提高原料平衡的转化率
【答案】D
【解析】
氮气和氢气净化干燥在一定压强及催化剂作用下加热反应生成氨气,液化分离得到氨气,氢气和氮气混合气体再循环使用。
A. 杂质能使催化剂中毒,所以反应前的氮气和氢气混合气体需要除杂净化,A正确;
B. 工业合成氨的正反应是气体体积减小的反应,增大压强既能促使平衡正向移动,增大原料的转化率,也能加快反应速率,B正确;
C. 氨气与酸反应得到铵盐可生产化肥,氨气易液化得到液氨,液氨变为气体时吸收周围热量可用作制冷剂,C正确;
D. 步骤③催化剂不改变化学平衡,反应物转化率不变;正反应为放热反应,升温平衡逆向移动,转化率减小。步骤④液化分离出氨气,平衡正向移动,反应物转化率增大。步骤⑤氮气和氢气循环使用有利于提高原料的转化率,D错误。
答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
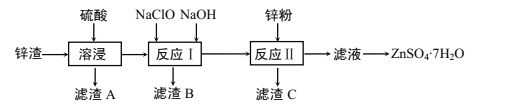
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O