题目内容
2.一定温度下在容积恒定的密闭容器中,进行反应A(s)+3B(g)?C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )①混合气体的密度
②容器内气体的压强
③混合气体总物质的量
④气体平均摩尔质量.
| A. | 只有①② | B. | 只有①②③ | C. | 只有②③④ | D. | ①②③④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体的密度不变,说明气体的质量不变,正逆反应速率相等,故正确;
②随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故正确;
③混合气体总物质的量不变,说明反应达平衡状态,故正确;
④如果正向进行,气体质量增加,而物质的量减少,气体平均摩尔质量增大,现在气体平均摩尔质量不变,说明反应达平衡状态,故正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 通入少量HCl气体,溶液中pH值增大 | |
| D. | 加入水时,平衡向逆反应方向移动 |
13.已知H2CO3?H++HCO${\;}_{3}^{-}$,K1=4.3×10-7,HCO3-?H++CO32-,K2=5.6×10-11;HClO?H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是( )
| A. | Ca(ClO)2+2HCl═CaCl2+2HClO | B. | Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2HCl | ||
| C. | NaClO+H2O+CO2═NaHCO3+HClO | D. | 2NaClO+H2O+CO2═Na2CO3+2HClO |
11.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol; CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-282.8kJ/mol.现有CO、H2、CO2组成的混合气体67.2L(标准状况),经充分燃烧后放出的总热量为710.0kJ,并生成18g液态水,求燃烧前混合气体中CO的体积分数为( )
| A. | 80% | B. | 50% | C. | 60% | D. | 20% |
12.从甜橙的芳香油中可分离得到如右图结构的化合物: ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )
 ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )| A. | 酸性KMnO4溶液 | B. | Ag(NH3)2OH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | H2/Ni |
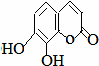 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.