题目内容
【题目】下列实验操作不正确的是
A. 蒸发时,残留的少量水让余热蒸干
B. 分液时,下层液体从下端放出,上层液体从上端倒出
C. 蒸馏时,冷水从冷凝管上口进下口出
D. 过滤时,漏斗下端紧贴烧杯内壁
【答案】C
【解析】
A. 蒸发时,当有大量固体析出时,残留的少量水让余热蒸干,故正确;
B. 分液时,为了使上下层液体完全分离,下层液体从下端放出,上层液体从上端倒出,故正确;
C. 蒸馏时,为了提高热交换的效率,让冷水从冷凝管下口进上口出,故错误;
D. 过滤时,漏斗下端紧贴烧杯内壁可以使液体能顺利流下,故正确。
故选C。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 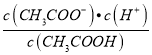
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
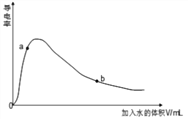
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余

