题目内容
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g)(正反应为放热反应),2SO2(g)+O2(g)
2NH3(g)(正反应为放热反应),2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应)。
2SO3(g)(正反应为放热反应)。
请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是。实际生产中采取的措施是、 。
(2)在合成氨的工业生产中,要分离出氨,目的是;而合成SO3的过程中,则不需要分离出SO3 , 原因是。
【答案】
(1)适当温度、高压、催化剂;合成氨:适当温度、高压、催化剂;合成SO3:适当温度、常压、催化剂
(2)减小生成物的浓度,使平衡向生成NH3的方向移动;该反应向生成SO3的方向进行的程度较大,达到平衡后SO2剩余量较少,故不需要分离SO3
【解析】工业上合成SO3与合成氨的最大不同之处是该反应是在常压下进行的,原因是在常压下该反应向生成SO3的方向进行的程度已经很大,采用高压虽能使平衡向生成SO3方向移动,但产生高压既需要动力又对反应容器耐压性有较高要求,综合生产成本和经济效益两方面因素,实际生产时,在常压下进行最合理。
【考点精析】本题主要考查了化学平衡移动原理以及影响因素的相关知识点,需要掌握影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动才能正确解答此题.

【题目】下列有关金属的说法中,不正确的是( )
A. 青铜、不锈钢、硬铝都是合金
B. 金属元素的单质只有还原性,其离子只有氧化性
C. 合金的硬度一般比它的各成分金属的大
D. 某些金属单质灼烧时火焰有颜色
【题目】800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)2NO2 , n(NO)随时间的变化如表所示.
时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)从0~3s内,用NO表示的平均反应速率v(NO)= .
(2)图中表示NO浓度变化的曲线是(填字母代号). 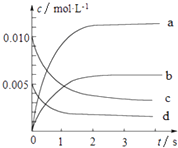
(3)达平衡时NO的转化率为 .
(4)能说明该反应已达到平衡状态的是(填序号). A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为 .





