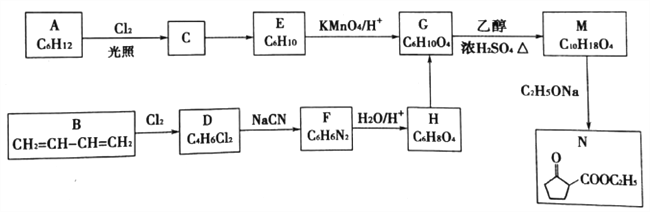
题目内容
【题目】下列物质,不能使高锰酸钾溶液褪色的是( )
A.乙烯
B.苯
C.乙炔
D.乙醛
【答案】B
【解析】解:A、乙烯中含碳碳双键,能被高锰酸钾氧化从而使高锰酸钾溶液褪色,故A错误;
B、苯不是单双键交替的结构,故不能使高锰酸钾溶液褪色,故B正确;
C、乙炔中含碳碳三键,能被高锰酸钾氧化从而使高锰酸钾溶液褪色,故C错误;
D、乙醛中含醛基,能被高锰酸钾氧化从而使高锰酸钾溶液褪色,故D错误;
故选B.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
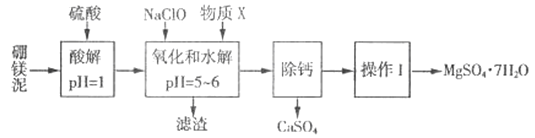
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。
【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
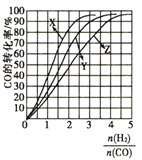
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。