题目内容
4.下列物质的制备中,不符合工业生产实际的是( )| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
分析 A、工业制备硝酸是利用氨气催化氧化生成一氧化氮,一氧化氮被氧化为二氧化氮,二氧化氮溶于水生成硝酸;
B、海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,最后萃取;
C、工业制漂白粉先是电解饱和食盐水得到氯气,用氯气和石灰乳反应得到漂白粉;
D、光照下氢气和氯气反应会爆炸,比较危险,不适用于工业制备.
解答 解:A、硝酸工业是利用氨气的催化氧化生成一氧化氮,一氧化氮被氧气氧化为二氧化氮,二氧化氮和水发生反应生成硝酸,即NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3,故A正确;
B、提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气发生氧化反应,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的发生还原反应,再通入适量氯气氧化溴离子为溴单质,即浓缩海水浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2,故B正确;
C、工业制漂白粉先是电解饱和食盐水得到氯气,用氯气和石灰乳反应得到漂白粉,故C正确;
D、光照下氢气和氯气反应会爆炸,比较危险,不适用于工业制备,应是氢气在氯气中燃烧生成氯化氢,氯化氢溶于水形成盐酸,故D错误;
故选D.
点评 本题考查了工业制备的过程分析,反应原理的应用,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意海水提溴的原理,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
14.如图是某条件时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
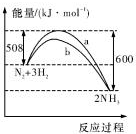

| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
15.氧元素有3种核素:${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O.下列有关氧元素的同位素说法中,不正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O的质子数相同 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同素异形体 | |
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相差2 | |
| D. | ${\;}_{8}^{17}$O原子核内中子数与核外电子数之差为1 |
12.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )


| A. | a为电池的正极 | B. | 放电时,b极电极反应式:Li-e-=Li+ | ||
| C. | 放电时,a极锂的化合价发生变化 | D. | 放电时,溶液中Li+从b向a迁移 |
19.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
9.下列装置不能完成相应实验的是( )
| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 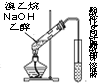 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 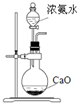 装置可用于实验室制备氨气 |
13.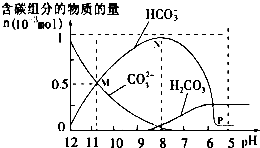 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
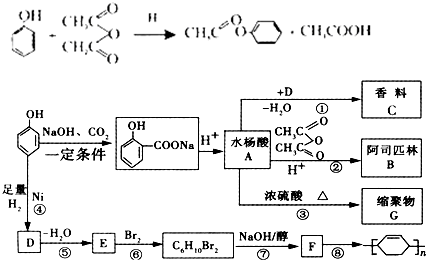
 .
. ;
;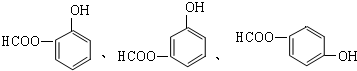 .
.