题目内容
2.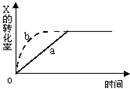 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
分析 改变条件使a曲线变为b曲线,根据图象知到达平衡时间缩短,但X的转化率不变,说明改变的条件只增大反应速率但不影响平衡移动,据此结合选项解答.
解答 解:A、增大体积,体系的压强降低,反应速率减小,到达平衡的时间增长,所以不符合条件,故A错误;
B、增大Y的浓度平衡向正反应方向移动,X的转化率增大,所以不符合条件,故B错误;
C、缩小体积,相当于增大了压强,反应速率增大,由于反应前后气体体积不变,压强不影响化学平衡的移动,故C正确;
D、降低温度平衡向逆反应方向移动,X的转化率降低,且反应时间增长,所以不符合条件,故D错误;
故选C.
点评 本题考查平衡图象、化学平衡的影响因素等,明确影响化学平衡的移动因素,注意“先拐先平数值大”即“先拐”的先达到平衡,对应反应速率大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
12.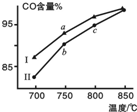 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})}$ |
13.HNO3中N原子轨道的杂化类型为( )
| A. | sp1 | B. | sp2 | C. | sp2 | D. | sp3 |
17.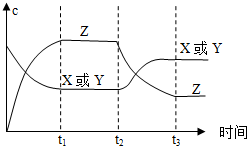 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
7.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,甲容器保持体积不变,乙容器保持压强不变,在相同温度下,发生2SO2(g)+O2(g)?2SO3(g)并达到平衡.则下列说法不正确的是( )
| A. | 平均反应速度:乙>甲 | B. | 平衡时SO3的物质的量甲>乙 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时混合气体的密度甲<乙 |
14.下列说法中,不正确的是( )
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
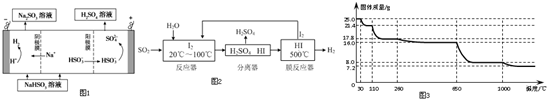
 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体. .
.