题目内容
7.下列离子方程式书写正确的是( )| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
分析 A.石炭酸为苯酚,属于弱酸,在离子反应中保留化学式;
B.电子不守恒;
C.遵循电子、电荷及原子守恒;
D.加入足量的氢氧化钠,-Br、-COOH均与NaOH反应.
解答 解:A.石炭酸与NaOH溶液混合的离子反应为C6H5OH+OH-→C6H5O-+H2O,故A错误;
B.稀HNO3洗涤试管中的银镜的离子反应为3Ag+NO3-+4H+═3Ag++NO↑+2H2O,故B错误;
C.乙烯使酸性KMnO4褪色的离子反应为5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O,故C正确;
D.向CH2BrCOOH中加足量的氢氧化钠溶液并加热的离子反应为CH2BrCOOH+2OH-$→_{△}^{H_{2}O}$CH2OHCOO-+Br-+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高考常见题型,综合性较强,涉及有机物的结构与性质、氧化还原反应等,注重基础知识的考查,选项A为解答的易错点,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
16.中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对它们进行研究具有重要意义.请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5待测试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
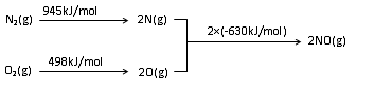
N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

N2(g)+O2(g)?2NO (g)△H=+183kJ/mol.
18.如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.该分子是( )
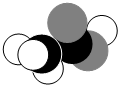

| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
2.“绿色化学”的核心理念是:原子经济性原则.即力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%.在合成1,2-二溴乙烷时,原子利用率最高的途径是( )
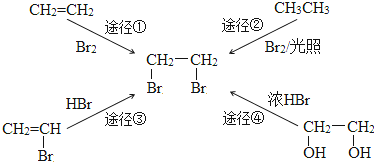

| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
12.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
19.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L(保留小数点后四位).
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
16.下列各组顺序的排列不正确的是( )
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
17.下列指定微粒的个数比等于2:1的是( )
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
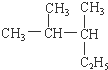 2,3-二甲基戊烷
2,3-二甲基戊烷