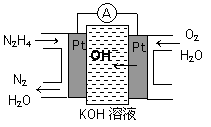
题目内容
写出下列热化学反应方程式
(1)N2(g)与H2(g)反应生成1 mol NH3(g),放出46.1 KJ热量.
_____________________
(2)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8 KJ热量.
_____________________
(3)1 mol C(石墨)与适量H2O(g)反应吸收131.3 KJ热量
_____________________
答案:
解析:
解析:
|
(1)1/2N2(g)+3/2H2(g)=NH3(g) ΔH=-46.1 kJ·mol-1 (2)C2H5OH(g)+3O2(g) (3)C(石墨s)+H2O(g) |

练习册系列答案
相关题目


 2CuO,CuO+H2SO4
2CuO,CuO+H2SO4 CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是________.
CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是________.