题目内容
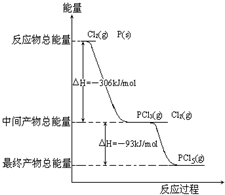 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1
| 3 |
| 2 |
P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1
.| 3 |
| 2 |
(2)PCl5分解成PCl3和Cl2的热化学方程式
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1
(3)P和Cl2分两步反应生成1molPCl5的△H3=
-399kJ?mol-1
-399kJ?mol-1
,P和Cl2一步反应生成1molPCl5的△H4等于
等于
△H3(填“大于”、“小于”或“等于”)分析:根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用.
解答:解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306lJ的能量,
则反应的热化学方程式为P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1,
故答案为:P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1;
(3)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ?mol-1;等于.
则反应的热化学方程式为P(s)+
| 3 |
| 2 |
故答案为:P(s)+
| 3 |
| 2 |
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1;
(3)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ?mol-1;等于.
点评:本题考查热化学方程式的书写以及盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据). 红磷P(s)和Cl2(g)之间的反应为①P(s)+
红磷P(s)和Cl2(g)之间的反应为①P(s)+