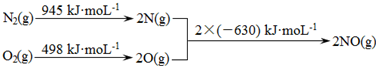题目内容
18.进行如下实验,在A锥形瓶中放入10g块状CaCO3,在B锥形瓶中放入5g粉末状CaCO3,分别加入50mL2mol/L盐酸.下图中能正确表示实验结果的是( )| A. |  | B. |  | C. |  | D. |  |
分析 增大固体的接触面积可以加快化学反应速率,根据盐酸和碳酸钙的反应情况来确定消耗的碳酸钙的量的多少.
解答 解:发生CaCO3+2HCl=CaCl2+H2O+CO2↑,A中n(CaCO3)=0.1mol,B中n(CaCO3)=0.05mol,n(HCl)=0.05L×2mol/L=0.1mol,由方程式可知A中盐酸不足,B中恰好完全反应,则生成的二氧化碳的体积相同,因碳酸钙粉末与盐酸的反应速率比碳酸钙固体的反应速率要快,则只有C正确.
故选C.
点评 本题考查外界条件对反应速率的影响为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意影响化学反应速率的因素以及物质发生变化的实质.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
8.恒温条件下,对于在一定体积的容器中进行的可逆反应C(s)+CO2(g)?2CO(g),下列描述不能说明该反应达到平衡状态的是( )
| A. | 体系压强不变 | B. | 气体平均相对分子质量不变 | ||
| C. | 气体密度不变 | D. | c(CO2):c(CO)=1:2 |
9.对甲苯丙烯酸的结构如图  下列说法错误的是( )
下列说法错误的是( )
 下列说法错误的是( )
下列说法错误的是( )| A. | 对甲苯丙烯酸的分子式为C10H10O2 | |
| B. | 对甲苯丙烯酸能发生的反应类型有加成、取代、氧化 | |
| C. | 对甲苯丙烯酸中所有碳原子有可能共平面 | |
| D. | 对甲苯丙烯酸能使酸性高锰酸钾溶液和溴水褪色,其原理相同 |
13.下列各组混合物的分离或提纯方法不正确的是( )
| A. | 用过滤的方法分离CaCO3和CaCl2溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解.冷却后它们都又重新生成固体) |
3.水蒸气通过炽热的炭层时,发生的反应为 C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,该反应属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
10.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①过滤 ②蒸发 ③溶解.
①过滤 ②蒸发 ③溶解.
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | 都相同 |
7.下列说法正确的是( )
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |


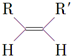 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO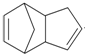 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$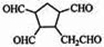 .
.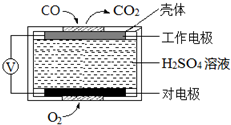 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.