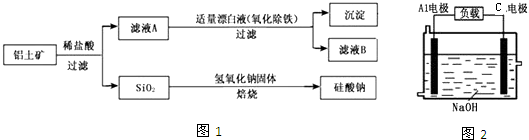
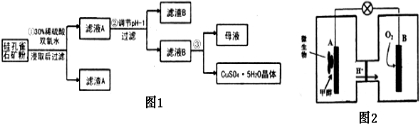
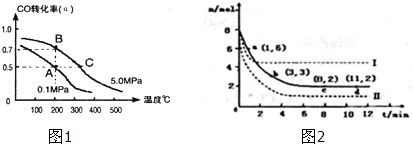
题目内容
金属钠、氧化钠和过氧化钠的混合物的质量为3.72g,与足量的水反应生成672mL混合气体(标准状况下),放电引燃,混合气体恰好完全反应,则原混合物中金属钠、氧化钠和过氧化钠的物质的量之比为( )
| A、1:1:1 |
| B、2:1:1 |
| C、1:2:1 |
| D、3:2:1 |
考点:有关混合物反应的计算
专题:计算题
分析:Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,由混合气体的体积可得出氢气、氧气的物质的量.氢气来源于钠和水的反应,通过氢气可求出钠的物质的量;氧气来源于过氧化钠与水的反应,通过氧气的物质的量可求出过氧化钠的物质的量.求出钠、过氧化钠的质量,总重量减去钠、过氧化钠的质量就是氧化钠的质量,质量除以摩尔质量可得氧化钠的物质的量,用钠、氧化钠、过氧化钠的物质的量之比即可.
解答:
解:Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,由混合气体的体积可得出氢气、氧气的物质的量.氢气来源于钠和水的反应,通过氢气可求出钠的物质的量;氧气来源于过氧化钠与水的反应,通过氧气的物质的量可求出过氧化钠的物质的量.求出钠、过氧化钠的质量,总重量减去钠、过氧化钠的质量就是氧化钠的质量,质量除以摩尔质量可得氧化钠的物质的量,用钠、氧化钠、过氧化钠的物质的量之比即可.
该混合气体通过放电,恰好完全反应,根据方程式2H2+O2
2H2O可知,氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,标准状况下得到672mL混合气体,所以氢气的体积为672ml×
=448ml,物质的量为0.02mol.氧气的体积为672ml-448ml=224ml,物质的量为0.01mol.
根据2Na+2H2O=2NaOH+H2↑可知,钠的物质的量为0.04mol,钠的质量为0.92g;
根据2Na2O2+2H2O=4NaOH+O2↑可知,过氧化钠的物质的量为0.02mol,过氧化钠的质量为0.02mol×78g/mol=1.56g.
所以氧化钠的质量为3.72g-0.92g-1.56g=1.24g,氧化钠的物质的量为
=0.02mol.
所以原混合物中钠、氧化钠、过氧化钠的物质的量之比0.04mol:0.02mol:0.02mol=2:1:1.
故选:B.
该混合气体通过放电,恰好完全反应,根据方程式2H2+O2
| ||
| 2 |
| 3 |
根据2Na+2H2O=2NaOH+H2↑可知,钠的物质的量为0.04mol,钠的质量为0.92g;
根据2Na2O2+2H2O=4NaOH+O2↑可知,过氧化钠的物质的量为0.02mol,过氧化钠的质量为0.02mol×78g/mol=1.56g.
所以氧化钠的质量为3.72g-0.92g-1.56g=1.24g,氧化钠的物质的量为
| 1.24g |
| 62g/mol |
所以原混合物中钠、氧化钠、过氧化钠的物质的量之比0.04mol:0.02mol:0.02mol=2:1:1.
故选:B.
点评:本题考查混合物计算,难度中等,确定混合气体中氢气与氧气的物质的量之比为2:1是关键,本解答针对计算型题目解答,对选择题,不宜使用,可根据氢气与氧气的物质的量之比,结合方程式,判断原混合物中钠与过氧化钠的物质的量之比,直接核对选项即可得答案.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A、乙烯水化制得乙醇 |
| B、甲烷与绿气制备一氯甲烷 |
| C、铜和浓硝酸为原料生产硝酸铜 |
| D、乙酸与乙醇制乙酸乙酯 |
2009年12月在哥本哈根召开的世界气候大会掀起了低碳经济的革命,它是人类社会继原始文明、农业文明、工业文明之后的又一大进步.下列做法不符合哥本哈根气候会议所倡导的“低碳经济”的是( )
| A、发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题 | ||||||
| B、加速建设城市地铁、轻轨等轨道交通,促进城市一体化发展,减少汽车尾气排放 | ||||||
| C、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 | ||||||
D、尽量使用含
|
下列做法不 符合倡导低碳生活这一主题的是( )
| A、采用绿色工艺,使原料尽可能转化为所需物质 |
| B、大量开采地下水,以满足社会需求 |
| C、开发利用绿色能源替代化石燃料 |
| D、严格执行机动车尾气排放标准 |