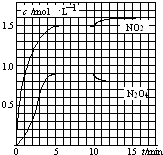
题目内容
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
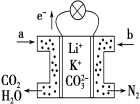
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
【答案】D
【解析】
试题分析:A.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,a电极是负极、b电极是正极,所以a是CH4,b为O2,故A错误;B.原电池放电时,阴离子向负极移动,则碳酸根离子向负极移动,故B错误;C.电解质为熔融碳酸盐,需要高温条件,故C错误;D.正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故D正确。故选D。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)在⑤~⑨元素中,原子半径最小的是 , 其离子的原子结构示意图为 , 离子半径最大的是 .
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 .
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式;
(4)按要求写出下列两种物质的电子式:②的氢化物;⑤的一种氧化物呈淡黄色,其含有的化学键类型有 , 电子式为 .
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
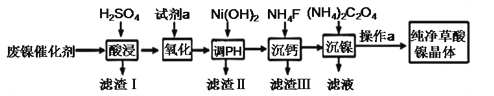
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。