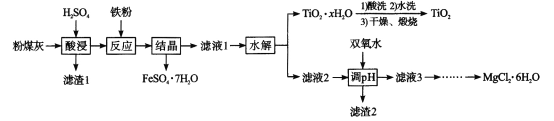
题目内容
【题目】①用50mL 0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称__,另一处错误是____。

②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择___molL-1的溶液进行实验。大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)。
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会____;(填“偏大、偏小、无影响”)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液所求中和热____(填“相等、不相等”)。
【答案】环形玻璃搅拌棒 小烧杯口和大烧杯口没有平齐 0.55 偏小 偏小 相等
【解析】
①根据装置图及实验步骤,确定缺少的仪器及错误之处;
②根据Q=cmt及H=-Q/n分析操作对中和热的影响。
①根据装置图,缺少的仪器为环形玻璃搅拌棒;有一处错误为大、小烧杯上沿未齐,大、小烧杯上沿齐平时,可减少气体产生对流,减小热量损失;
②为了使盐酸充分反应,减少误差,则使用稍过量的NaOH溶液,应选用0.55mol/L的NaOH溶液;大烧杯上如不盖硬纸板,热量损失较多,计算出的中和热数值偏小;
③用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液时,醋酸为弱电解质,电离时吸收热量,导致中和热的数值偏小;用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液时,放出的热量增大,生成的水也增大,中和热的焓变不变。

 名校课堂系列答案
名校课堂系列答案【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量