题目内容
【题目】准确称取6.00克铝土矿样品(含Al2O3、Fe2O3、SiO2),将其放入盛有100毫升H2SO4溶液的烧杯中,充分反应后滤出沉淀物。在滤液X中加入10摩/升的NaOH溶液,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
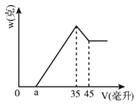
(1)分析图象可知滤液X中所含有的溶质成分为_____(填化学式)。
(2)H2SO4溶液的物质的量浓度是__________?
(3)图中a值为2.3毫升时,铝土矿样品中Fe2O3的质量分数_________________。
(4)a值的变化范围是____________________?
【答案】Al2(SO4)3、Fe2(SO4)3、H2SO4 1.75mol/L 12% 1.625<a<5
【解析】
铝土矿中的氧化铝和氧化铁可以溶于硫酸,二氧化硅不溶于硫酸,过滤后的溶液中肯定含有硫酸铝和硫酸铁,根据图像分析,加入氢氧化钠溶液,先没有沉淀,说明原溶液中含有酸,即酸有剩余,再加入氢氧化钠,铁离子和铝离子分别反应生成氢氧化铁和氢氧化铝沉淀,再加入氢氧化钠溶液,氢氧化铝沉淀溶解,沉淀量减少,最后剩余氢氧化铁沉淀。
(1)根据图像分析,加入氢氧化钠开始没有沉淀,说明酸有剩余,所以得到的滤液中的成分为 Al2(SO4)3、Fe2(SO4)3 、H2SO4 ;
(2)当生成沉淀最大量时,溶液中的溶质为硫酸钠,根据质量守恒分析,氢氧化钠的物质的量为10×0.035=0.35mol,则硫酸的浓度为![]() =1.75mol/L ;
=1.75mol/L ;
(3)根据图像,溶解氢氧化铝消耗的氢氧化钠的物质的量为10×(45-35)×10-3=0.1mol,则生成氢氧化铝消耗的氢氧化钠的物质的量为0.3mol,若a为2.3毫升,则铁离子消耗的氢氧化钠的物质的量为10×0.035-0.3-10×0.0023=0.027mol,则铁离子物质的量为0.009mol,则原混合物中氧化铁的质量分数为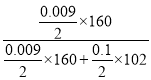 ×100%=12% ;
×100%=12% ;
(4)从前面分析,35毫升氢氧化钠溶液中有30毫升是铝离子沉淀消耗的,若没有氧化铁,则a为5毫升,氧化铝的质量为![]() =5.1克,若剩余6.0-5.1=0.9克全为氧化铁,则氧化铁的物质的量为
=5.1克,若剩余6.0-5.1=0.9克全为氧化铁,则氧化铁的物质的量为![]() mol,沉淀铁离子需要的氢氧化钠的体积为
mol,沉淀铁离子需要的氢氧化钠的体积为![]() =3.375毫升,则a为5-3.375=1.625mL,则a的范围为: 1.625<a<5。
=3.375毫升,则a为5-3.375=1.625mL,则a的范围为: 1.625<a<5。