题目内容
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,该反应的热化学方程式正确的是( )
A.![]() ,DH=-11.46kJ/mol
,DH=-11.46kJ/mol
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(aq),DH=-114.6kJ/mol
C.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l),DH=-114.6kJ/mol
D.![]() ,DH=-57.3kJ/mol
,DH=-57.3kJ/mol
答案:CD
提示:
提示:
恰好完全反应,生成0.2mol水,放出11.46kJ热量,放热用“-”表示。热化学方程式前的系数表示物质的量之比。
|

练习册系列答案
相关题目
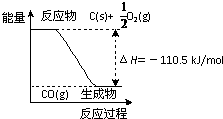 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )