题目内容
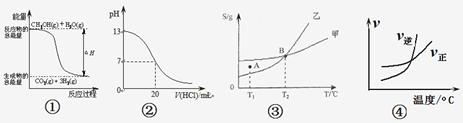
【题目】在常温下,向 100mL0.01mol/LHA 溶液中逐滴加入 0.02mol/LMOH 溶液,混合溶液的pH 变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
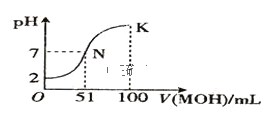
A.MA 溶液的 pH > 7
B.K 点时加水稀释溶液,c(H+)减小
C.在 N 点,c(A) = c(M+) + c(MOH)
D.在 K 点,c(M+) > c(A) > c(OH) > c(H+)
【答案】D
【解析】
A.根据图象可知,0.01molL-1HA溶液中pH=2,则HA在溶液中完全电离,则HA为强酸;100mL0.01molL-1HA溶液中加入51mL 0.02molL-1MOH溶液时,溶液的pH=7,则加入50mL该MOH溶液时,混合液为酸性,数目MOH为弱碱,则MA为强酸弱碱盐,其溶液呈酸性,MA溶液的pH<7,故A错误;
B.K点溶液呈碱性,稀释后溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故B错误;
C.N点溶液呈中性,则c(OH-)=c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(A-)=c(M+),故C错误;
D.在K点时混合溶液体积是碱溶液的2倍,溶液pH>7,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒c(OH-)+c(OH-)=c(H+)+c(M+)可得,c(M+)>c(A-),溶液中各离子浓度大小为:c(M+)>c(A-)>c(OH-)>c(H+),故D正确;
故答案为D。

【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如图1。
和CH3CH2CH2Br的方法如图1。
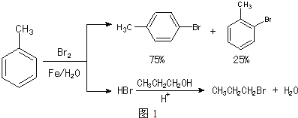
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入____,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式___。
(2)反应装置如图3所示:
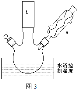
①图中玻璃仪器a的名称是____,方块b中为某玻璃仪器,其名称是___。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和____,加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是____。
(3)操作I的名称是___,操作Ⅲ的名称是___。