题目内容
SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
- A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
- B.已知NaHSO3溶液pH<7,该溶液中:c(Na+)>c(HSO3-)>c(H2SO3) >c(SO32-)
- C.当吸收液呈中性时:c(Na+)=2 c(SO32-)+c(HSO3-)
- D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
C
试题分析:A、水解时分步的,第一步水解大于第二步水解,故c(HSO3-)>c(H2SO3),错误;B、pH<7,说明该溶液电离大于水解,故有c(SO32-)>c(H2SO3),错误;C、根据电荷守恒,可以得到,正确;D、该式为NaHSO3的物料守恒,但该溶液不一定为NaHSO3,错误。
考点:考查电解质溶液,涉及弱电解的电离、盐类水解、三大守恒关系的应用。
试题分析:A、水解时分步的,第一步水解大于第二步水解,故c(HSO3-)>c(H2SO3),错误;B、pH<7,说明该溶液电离大于水解,故有c(SO32-)>c(H2SO3),错误;C、根据电荷守恒,可以得到,正确;D、该式为NaHSO3的物料守恒,但该溶液不一定为NaHSO3,错误。
考点:考查电解质溶液,涉及弱电解的电离、盐类水解、三大守恒关系的应用。

练习册系列答案
相关题目
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
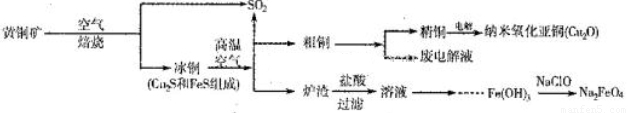
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
|
n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
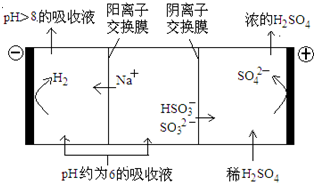 (2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.