题目内容
A. 将配好的稀硫酸倒入试剂瓶中,贴好标签;
B. 盖好容量瓶塞,反复颠倒,摇匀;
C. 用量筒取 mL的18.0mol/L的浓硫酸;
D. 将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
E. 用少量蒸馏水洗涤烧杯2—3次,并将洗涤液也全部转移到容量瓶中;
F. 将已冷却至室温的硫酸溶液沿玻璃棒注入100mL的容量瓶中;
G. 改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H. 继续向容量瓶加蒸馏水,直到液面接近刻度线 cm处。
(1)填写上述步骤中的空白;
(2)请按正确的操作步骤进行排序 。
(3)试分析下列操作会使所配溶液的浓度会大于1.80mol/L浓度( )
A.用量筒取浓硫酸时,为了精确,用水洗涤量筒,并将洗涤液倒入烧杯中。
B.溶解后,立刻移液。
C.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线。
D.若定容时仰视看刻度线,会使稀硫酸溶液的浓度。
E.若摇匀后发现液面低于刻度线,又加水至刻度线。
(4)取20ml配好的硫酸,和足量的铝反应后,可收集到标准状况下的H2 ml.
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
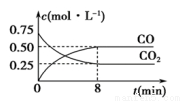
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B .增大压强 C.充入一定量CO D.降低温度
.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。


 溶液中能大量共存的无色透明离子组是( )
溶液中能大量共存的无色透明离子组是( ) m(NaOH)
m(NaOH) zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的二倍,再达平衡时,测得A的浓度降低为0.24 mol/L。下列有关判断错误的是
zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的二倍,再达平衡时,测得A的浓度降低为0.24 mol/L。下列有关判断错误的是