题目内容
则(1)该条件下的平衡常数K=
(2)氮气的转化率
(3)平衡时的压强与起始时的压强之比
| 5 |
| 6 |
| 5 |
| 6 |
(1)根据化学平衡常数表达式K=
| C2(NH3) |
| C (N2)C3(H2) |
(2)根据转化率的定义计算;
(3)根据压强之比等于物质的量之比来计算;
N2 +3H2
 2NH3,
2NH3,开始(mol):0.80 1.60 0
变化(mol):n 3n 2n
平衡(mol):0.80-n 1.60-3n 2n
达到平衡时,NH3的体积分数为20%,所以
| 2n |
| 0.80 -n+1.60-3n+2n |
平衡时C(N2)=0.3mol/L,C(H2)=0.5mol/L,C(NH3)=0.2mol/L,
(1)该条件下的平衡常数K=
| C2(NH3) |
| C (N2)C3(H2) |
| 0.2 2 |
| 0.3×0.5 3 |
(2)氮气的转化率为
| 0.2mol |
| 0.80mol |
(3)平衡时的压强与起始时的压强之比为
| 0.80 -n+1.60-3n+n |
| 0.80+1.60 |
| 2.4-0.4 |
| 2.4 |
| 5 |
| 6 |
| 5 |
| 6 |

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。

a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
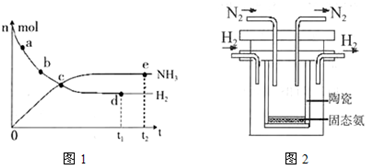
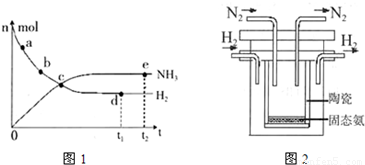
 实验
实验 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。 
 2NH3(g)的平衡常数K=____________。
2NH3(g)的平衡常数K=____________。
 2NH3(g)+3/2O2(g) △H=akJ/mol进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
2NH3(g)+3/2O2(g) △H=akJ/mol进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表: 
 2NH3(g) △H=-92.4kJ/mol 2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol
2NH3(g) △H=-92.4kJ/mol 2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol