题目内容
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去)
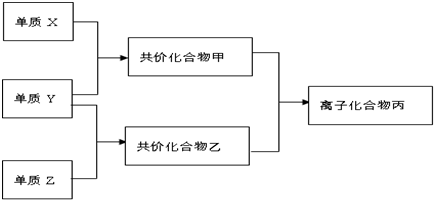
已知:a.常见双原子单质分子中,X分子含共价键最多;
b.甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的电子式是 ;甲的电子式是 ;
(2)化合物丙中含有化学键的类型 ;
(3)写出甲与乙反应生成丙的化学方程式 .

已知:a.常见双原子单质分子中,X分子含共价键最多;
b.甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的电子式是
(2)化合物丙中含有化学键的类型
(3)写出甲与乙反应生成丙的化学方程式
考点:无机物的推断
专题:推断题
分析:常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,以此解答该题.
解答:
解:常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,
(1)X为N2,分子中含有3个共价键,电子式为 ,化合物甲为NH3,为共价化合物,电子式为
,化合物甲为NH3,为共价化合物,电子式为 ,
,
故答案为: ;
; ;
;
(2)化合物丙为NH4Cl,为离子化合物,含有离子键和共价键,
故答案为:离子键、共价键(或极性键);
(3)甲为NH3,乙为HCl,甲与乙反应生成丙的化学方程式为NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl.
(1)X为N2,分子中含有3个共价键,电子式为
 ,化合物甲为NH3,为共价化合物,电子式为
,化合物甲为NH3,为共价化合物,电子式为 ,
,故答案为:
 ;
; ;
;(2)化合物丙为NH4Cl,为离子化合物,含有离子键和共价键,
故答案为:离子键、共价键(或极性键);
(3)甲为NH3,乙为HCl,甲与乙反应生成丙的化学方程式为NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl.
点评:本题考查无机物的推断,题目难度不大,注意把握题中信息,认真审题,为解答该题的关键,学习中注重相关基础知识的积累.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
某有机物与过量的金属钠反应,得到VA L气体,另一份等质量的该有机物与纯碱反应得到气体VB L(同温、同压),若VA>VB,则该有机物可能是( )
| A、HOCH2CH2OH |
| B、CH3COOH |
| C、HOOC-COOH |
| D、HOOC-C6H4-OH |
利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为:
 ;△H=+88.62kJ?mol-1以下叙述不正确的是( )
;△H=+88.62kJ?mol-1以下叙述不正确的是( )

| 光照 |
| 暗处 |
 ;△H=+88.62kJ?mol-1以下叙述不正确的是( )
;△H=+88.62kJ?mol-1以下叙述不正确的是( )| A、Q的一氯代物只有3种 |
| B、NBD和Q互为同分异构体 |
| C、NBD的能量比Q的能量低 |
| D、NBD不能使酸性KMnO4溶液褪色而Q能 |
对A(g)+3B(g)?2C(g)来说,下列反应速率中最快的是( )
| A、v(A)=0.3mol/(L?min) |
| B、v(B)=0.6mol/(L?min) |
| C、v(C)=0.5mol/(L?min) |
| D、v(A)=0.01mol/(L?s) |
1mol丙烷在光照条件下与氯气反应,如果丙烷中的H原子完全被取代,则需要多少mol的氯气( )
| A、4mol | B、6mol |
| C、7mol | D、8mol |
某药物的有效成分X的结构为 ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A、1 mol X最多能与4 mol Br2发生加成反应 |
| B、该物质遇FeCl3溶液呈紫色 |
| C、X的分子式为C9H8O4 |
| D、该物质中含有两种官能团 |
 ,试推测(A)和(B)的结构式.
,试推测(A)和(B)的结构式.