题目内容
15.下列叙述中正确的是( )| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间的作用力越大,该分子越稳定 | |
| C. | 分子晶体中,共价键的键能越大,熔沸点越高 | |
| D. | 原子晶体中,构成晶体的微粒一定是相同的原子 |
分析 A.原子晶体中,共价键的键能越大,熔沸点越高;
B.分子晶体中,分子间作用力越大,熔沸点越高,共价键的键能越大,稳定性越大;
C.分子晶体中,分子间作用力越大,熔沸点越高,共价键的键能越大,稳定性越大;
D.原子晶体中,构成原子可能不同.
解答 解:A.原子晶体中,共价键的键能越大,熔、沸点越高,键能决定其熔沸点,故A正确;
B.分子晶体中,分子间作用力越大,熔沸点越高,共价键的键能越大,稳定性越大,则共价键的键能越大,该分子越稳定,故B错误;
C.分子晶体中,分子间作用力越大,熔沸点越高,共价键的键能越大,稳定性越大,则分子间的作用力越大,熔、沸点越高,故C错误;
D.原子晶体中,构成原子可能不同,如二氧化硅属于原子晶体,构成微粒为Si原子和O原子,故D错误;
故选A.
点评 本题考查晶体类型与物质稳定性、熔沸点的关系,明确分子晶体、原子晶体的熔沸点的比较方法即可解答,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
5.下列有关氧化还原反应的叙述正确的是( )
| A. | 元素化合价升高的反应是还原反应 | |
| B. | 物质在变化中失去了电子,此物质中的某一元素化合价降低 | |
| C. | 有电子转移的反应就是氧化还原反应 | |
| D. | 有化合价升降的反应,不一定是氧化还原反应 |
6.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为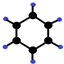 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
7.下列说法正确的是( )
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| B. | 在101kPa时,1molH2完全燃烧生成水蒸汽,放出285.8kJ热量,H2的燃烧热为△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1molC与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量等于57.3kJ |
 A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
 ;
; ;
; .
. H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题: ;
;