题目内容
15.下列对应关系不正确的是( )| A | B | C | D |
 |  |  |  |
| Si3N4 | NaOH | Al(OH)3 | C12H22O11 |
| 制造汽车发动机 | 制肥皂 | 抗酸药 | 做调味剂、防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氮化硅(Si3N4)是一种具有耐高温、耐磨蚀等优异性能的新型陶瓷,属于新型无机材料;
B.NaOH属于强碱,具有强腐蚀性;
C.氢氧化铝为弱碱,可中和胃酸;
D.冰糖的主要成分为蔗糖,可做调味剂、防腐剂.
解答 解:A.氮化硅(Si3N4)是一种具有耐高温、耐磨蚀等优异性能的新型陶瓷,属于新型无机材料,可用于制造汽车发动机,故A正确;
B.NaOH属于强碱,具有强腐蚀性,不具有强氧化性,故B错误;
C.氢氧化铝为弱碱,可中和胃酸,故C正确;
D.冰糖的主要成分为蔗糖,可做调味剂、防腐剂,故D正确.
故选B.
点评 本题考查物质的成分和用途,为高频考点,侧重化学与生活的考查,有利于培养学生的良好的科学素养,难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
5.某有机物X的结构简式如下图所示,则下列有关说法中正确的是( )


| A. | 有机物X的含氧官能团有3种 | |
| B. | X分子中苯环上的一氯取代物有3种 | |
| C. | 在Ni作催化剂的条件下,1mol X 最多能与5 mol H2加成 | |
| D. | X在一定条件下能发生加成、取代、消去等反应 |
3.下列有关描述正确的是( )
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 石油化工中的裂化、裂解过程都是通过化学反应来获得气态烯烃 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
10.化学与生产、生活、军事、科研产品紧密相关,下列说法错误的是( )
| A. | 家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| B. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,所以次氯酸钠溶液可以将病毒氧化而达到消毒的目的 | |
| C. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| D. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 |
7.下列药品和装置合理且能完成相应实验的是( )
| A. |  检验装置气密性 | B. |  收集气体 | ||
| C. | 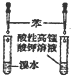 验证苯中不含有碳碳双键 | D. |  实验室制取并收集氨气 |
5.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 航天服材质是由碳化硅、陶瓷和碳纤维等复合而成,它是一种新型有机合成材料 | |
| B. | 煤中含有苯、二甲苯等,可以通过煤的干馏得到,并将它们分离 | |
| C. | 经过一定的化学变化,可以从海水中提取氯化钠、镁、溴等 | |
| D. | 在海轮外壳镶嵌锌块,能减缓轮船的腐蚀,是利用牺牲阳极的阴极保护法 |
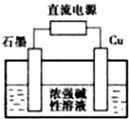 金属单质及其化合物在工农业生产中应用广泛.
金属单质及其化合物在工农业生产中应用广泛.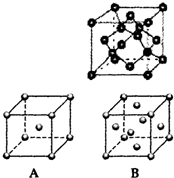 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题: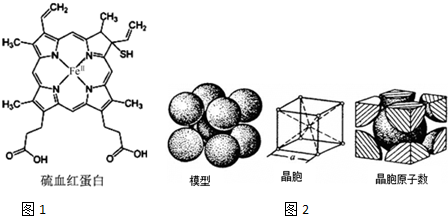
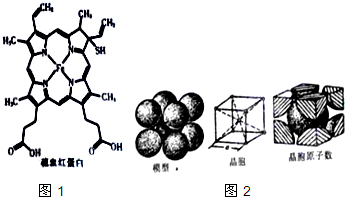 血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题:
血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题: