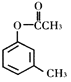
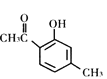
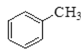
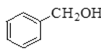
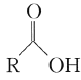
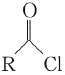
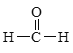题目内容
【题目】在周期表中,锗和硅位于同主族。四氯化锗(GeCl4)是光导纤维的掺杂剂,其熔点为-49.5℃, 沸点为83.1℃;易水解,对上呼吸道及皮肤有刺激作用。实验室制备四氯化锗的原理是:Ge+2Cl2=GeCl4。某课题组同学拟选择下列装置设计实验制备四氯化锗(部分加热装置和夹持装置省略)。回答下列问题:
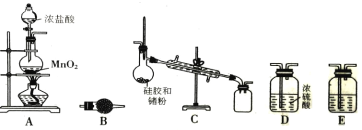
(1)写出A装置中发生反应的化学方程式_______________。
(2)若气体从左到右流动,则装置连接顺序为A、_______________。
(3)C装置中用于冷凝四氯化锗蒸气的仪器名称是_______________,B装置中的试剂是_______________。
(4)E装置中的试剂是_______________,其作用是_______________。
(5)下列有关说法正确的是_______________。
①实验中,先通入氯气,后加热C中烧瓶
②C装置中温度计的温度控制在49℃左右
③观察到D瓶有气泡和液面上有黄绿色气体
④C装置中硅胶的主要作用可能是干燥产品
(6)四氯化锗遇水蒸气产生一种强酸和一种弱酸。实验室用足量NaOH溶液吸收尾气中少量四氯化锗气体,写出该反应的化学方程式:__________________。
(7)实验中消耗m g 纯锗粉制得a g GeCl4,则锗的利用率为_______________(用含 m、a 的代数式表示)。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O E、D、C、B (直形)冷凝管 碱石灰 饱和食盐水 除去氯气中的氯化氢 ①③ GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O
MnCl2+Cl2↑+2H2O E、D、C、B (直形)冷凝管 碱石灰 饱和食盐水 除去氯气中的氯化氢 ①③ GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O ![]() ×100%
×100%
【解析】
(1) 在A装置中浓盐酸与MnO2混合加热制取Cl2;
(2)根据制取的气体中的成分,对气体净化除杂、发生反应制取四氯化锗,同时结合四氯化锗易水解的性质在制取时要避免接触水蒸气分析;
(3)根据仪器结构判断仪器名称;根据装置B中试剂作用判断使用的试剂;
(4)装置E中试剂作用吸收氯气中的杂质HCl,不能反应消耗Cl2;
(5)空气中含有水蒸气,会干扰实验的进行,结合各种物质的性质及装置的作用分析判断;
(6)GeCl4与水反应产生HCl和H2GeO3,然后根据酸碱中和反应原理,书写反应方程式;
(7)根据反应产生GeCl4的质量计算消耗的Ge,然后计算Ge的利用率。
(1)在A装置中浓盐酸与MnO2混合加热制取Cl2,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)实验装置连接顺序为:使用装置A制取Cl2,通过装置E中的饱和食盐水除去Cl2中的杂质HCl、通过装置D干燥氯气、然后在装置C中反应产生GeCl4、最后用装置B进行尾气处理,故若气体按照从左到右流动,则装置连接顺序为A、E、D、C、B;
(3)根据装置图可知:C装置中用于冷凝四氯化锗蒸气的仪器名称是(直形)冷凝管;B装置的作用是吸收未反应的氯气、防止污染空气,并防止外界空气中的水蒸气进入C装置中,即同时起干燥作用,可选择使用碱石灰;
(4)装置E的作用是用于除去Cl2中的杂质HCl,同时不能反应消耗Cl2,可根据Cl2与水反应是可逆反应,根据平衡移动原理,使用饱和NaCl溶液除去Cl2中的杂质HCl;
(5)①实验中,先通入氯气,后加热C中烧瓶可排出装置中的空气,避免空气中的氧气与锗粉反应产生氧化锗,同时也可以防止空气中的水蒸气与反应产生的GeCl4发生水解作用, ①正确;
②GeCl4的沸点是83.1℃,故C装置中温度计的温度要控制略高于83.1℃,②错误;
③浓硫酸的作用是干燥氯气,因此会观察到D瓶有气泡和液面上有黄绿色气体,③正确;
④硅胶是多孔状物质,可作反应的载体,能增大锗粉与氯气反应的接触面积,而不是作干燥剂,且反应产生四氯化锗产品时没有生成水,④错误;
故合理选项是①③;
(6)四氯化锗与NaOH溶液反应分两步进行,首先是四氯化锗与溶液中的水反应产生HCl和H2GeO3,GeCl4+3H2O=4HCl+H2GeO3,然后是反应得到的两种酸分别与NaOH发生中和反应:HCl+NaOH=NaCl+H2O;H2GeO3+2NaOH=Na2GeO3+2H2O,反应的总方程式为:GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O;
(7)m g锗粉的物质的量是n(Ge)=![]() mol,实际上产生GeCl4质量是a g,a g GeCl4的物质的量是n(GeCl4)=
mol,实际上产生GeCl4质量是a g,a g GeCl4的物质的量是n(GeCl4)=![]() mol,根据Ge元素守恒,消耗Ge的物质的量为n(Ge)=
mol,根据Ge元素守恒,消耗Ge的物质的量为n(Ge)=![]() mol,则Ge的利用率为:
mol,则Ge的利用率为: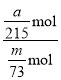 ×100%=
×100%=![]() ×100%。
×100%。