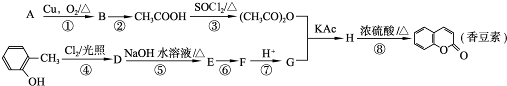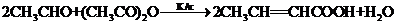题目内容
(2012?济南二模)SO2是硫酸工业尾气的主要成分.实验室中,拟用下图所示流程,测定标准状况下,体积为V L的硫酸工业尾气中SO2的含量: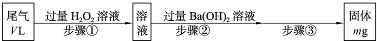
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为
(2)步骤③的操作依次是:过滤
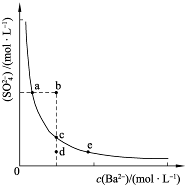
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示.步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数
浓度的变化情况为
①d→c→e ②b→c→d ③a→c→e ④d→c→a
(4)该V L尾气中SO2的体积分数为
×100%
×100%(用含有V、m的代数式表示).
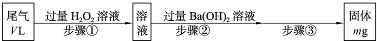

(1)步骤①中加入H2O2溶液时发生反应的离子方程式为
H2O2+SO2=2H++SO42-
H2O2+SO2=2H++SO42-
,1mol H2O2参加反应,转移的电子数为1.204×1024
1.204×1024
.(2)步骤③的操作依次是:过滤
过滤
过滤
、洗涤
洗涤
、干燥
干燥
、称重.(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示.步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数
不变
不变
(填“增大”、“减小”、“不变”之一),溶液中S| O | 2- 4 |
③
③
(填序号)①d→c→e ②b→c→d ③a→c→e ④d→c→a
(4)该V L尾气中SO2的体积分数为
| m×22.4 |
| 233V |
| m×22.4 |
| 233V |
分析:(1)过程中发生的反应为:SO2+H2O2=H2SO4,H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(2)步骤③的操作是从溶液中分离出沉淀硫酸钡,操作步骤是过滤、洗涤、干燥、称重;
(3)溶度积常数随温度变化,不随浓度改变;沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;
(4)mg是硫酸钡的质量,计算硫酸钡的物质的量,根据硫元素守恒计算二氧化硫的体积,进而计算二氧化硫的体积分数;
(2)步骤③的操作是从溶液中分离出沉淀硫酸钡,操作步骤是过滤、洗涤、干燥、称重;
(3)溶度积常数随温度变化,不随浓度改变;沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;
(4)mg是硫酸钡的质量,计算硫酸钡的物质的量,根据硫元素守恒计算二氧化硫的体积,进而计算二氧化硫的体积分数;
解答:解:(1)步骤①中加入H2O2溶液,过氧化氢具有氧化性,二氧化硫具有还原性被氧化为硫酸,发生反应的离子方程式为H2O2+SO2=2H+++SO42-,1mol过氧化氢反应转移电子物质的量为2mol,转移的电子数为2×6.02×1023=1.204×1024;
故答案为:H2O2+SO2=2H+++SO42-,1.204×1024;
(2)步骤③的操作是从溶液中分离出沉淀硫酸钡,操作步骤是过滤、洗涤、干燥、称重;
故答案为:洗涤,干燥;
(3)沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;bd点不是该温度下的饱和溶液;
故答案为:不变,③;
(4)mg是硫酸钡的质量,硫酸钡的物质的量为
=
mol,根据硫元素守恒可知二氧化硫的体积为
mol×22.4L/mol=
L,故尾气中二氧化硫的体积分数=
=
×100%;
故答案:
×100%;
故答案为:H2O2+SO2=2H+++SO42-,1.204×1024;
(2)步骤③的操作是从溶液中分离出沉淀硫酸钡,操作步骤是过滤、洗涤、干燥、称重;
故答案为:洗涤,干燥;
(3)沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;bd点不是该温度下的饱和溶液;
故答案为:不变,③;
(4)mg是硫酸钡的质量,硫酸钡的物质的量为
| mg |
| 233g/mol |
| m |
| 233 |
| m |
| 233 |
| 22.4m |
| 233 |
| ||
| VL |
| m×22.4 |
| 233V |
故答案:
| m×22.4 |
| 233V |
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算、沉淀溶解平衡等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目