题目内容
将0.5mol A元素的阳离子还原为中性原子,需要得到1mol电子.0.4g A的单质与足量盐酸反应,生成上述A的阳离子时,可放出0.02g氢气.则A为________元素(写出推理过程).
答案:
解析:
解析:
|
导解:因为0.5mol A的阳离子还原成原子需1mol电子,故可知A的阳离子为+2价,所以A与盐酸反应的离子方程式为:(设A的摩尔质量为x) A+2H+=A2++H2↑ x 2g 0.4g 0.02g |

练习册系列答案
相关题目
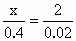 ,解得x=40,所以此元素为钙.
,解得x=40,所以此元素为钙.