题目内容
9.下列关于工业生产的说法正确的是( )| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |
分析 A.氨气溶解度非常大,CO2的溶解度相对于氨气来说很小;
B.采用化学反应产物的循环利用可以提高原料利用率;
C.氯碱工业产物氯气和氢氧化钠能腐蚀Fe;
D.甲烷不容易分解,甲烷与水蒸汽高温反应生成氢气和CO,CO可以用作燃料.
解答 解:A.因为氨气溶解度非常大,先通氨气后通二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故A错误;
B.在硫酸工业、合成氨工业、硝酸工业中的主要反应为可逆反应,原料不能完全转化为产物,采用反应物的循环利用可以提高原料利用率,故B正确;
C.氯碱工业产物氯气和氢氧化钠能腐蚀Fe,所以电解槽一般不能用铁网作电极,故C错误;
D.甲烷不容易分解,甲烷与水蒸汽高温反应生成氢气和CO,氢气由于合成氨,CO可以用作燃料,所以用天然气造气的方法中,与水蒸汽高温反应优于热分解法,故D正确.
故选BD.
点评 本题是一道以工业生产为知识背景的综合性题目,考查角度广,题目难度不大,可以根据有关工业生产的原理进行解答,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列物质中有固定熔点的是( )
| A. | 聚乙烯 | B. | 氯化钠 | C. | 淀粉 | D. | 聚1,3-丁二烯 |
17.下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A. | CCl4 | B. | BeCl2 | C. | BF3 | D. | HClO |
13.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: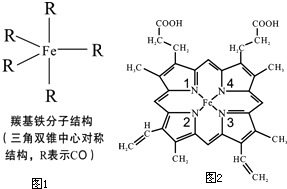 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题: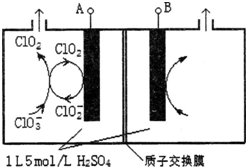 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.