题目内容
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
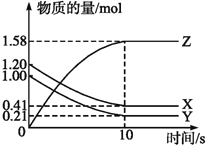
(1)写出该反应的化学方程式__________。
(2)计算反应开始到10 s,用X表示的反应速率是__________,Y的转化率为______。
(3)下列叙述中能说明上述反应达到平衡状态的是____。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是_____________。
(5)为使该反应的反应速率增大,可采取的措施是______.
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
【答案】 X(g)+Y(g)![]() 2Z(g) 0.0395 mol·(L·s)-1 79.0% B 2v正(Y)=v逆(Z ) bcd
2Z(g) 0.0395 mol·(L·s)-1 79.0% B 2v正(Y)=v逆(Z ) bcd
【解析】试题分析:(1)据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应,系数比等于浓度变化量比;
(2)根据速率计算公式计算反应开始到10 s,用X表示的反应速率,Y的转化率=变化量÷起始量。
(3)根据化学平衡定义判断平衡标志。
(4) 当反应达到平衡时,正逆反应速率的比等于系数比。
(5)根据影响反应速率的因素判断.
解析:(1)据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应,X、Y的变化量都是0.79mol,z的变化量是1.58mol,系数比等于浓度变化量比,所以反应方程式为X(g)+Y(g)![]() 2Z(g);
2Z(g);
(2)根据速率计算公式,反应开始到10 s,用X表示的反应速率![]() 0.0395 mol·(L·s)-1,Y的转化率=
0.0395 mol·(L·s)-1,Y的转化率=![]() 79.0% 。
79.0% 。
(3)A.当X与Y的反应速率都是指正反应速率,方向相同,不一定平衡,故A错误;
B.根据平衡定义,混合气体中X的质量百分数保持不变,一定平衡,故B正确;
C.根据 ,气体总质量不变、总物质的量不变,混合气体的平均摩尔质量是恒量,平均摩尔质量不随时间的变化而变化,不一定平衡,故C错误;
,气体总质量不变、总物质的量不变,混合气体的平均摩尔质量是恒量,平均摩尔质量不随时间的变化而变化,不一定平衡,故C错误;
D.根据![]() ,气体质量、气体体积都是不变,混合气体的的密度是恒量,混合气体的的密度不随时间的变化而变化,不一定平衡,故D错误;
,气体质量、气体体积都是不变,混合气体的的密度是恒量,混合气体的的密度不随时间的变化而变化,不一定平衡,故D错误;
E.X、Y、Z的浓度之比,不能作为平衡标志,故E错误。
(4) 当反应达到平衡时,正逆反应速率的比等于系数比,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是2v正(Y)=v逆(Z )。
(5)a.恒容时充入Ne,浓度不变,速率不变,故a错误; b.升高温度,速率一定加快,故b正确;c.缩小容器的体积 ,浓度增大,速率加快,故c正确; d.选择高效催化剂,,速率加快,故d正确;

 阅读快车系列答案
阅读快车系列答案【题目】(多选)下列分离和提纯物质的方法错误的是( )
物质 | 杂志 | 试剂或用品 | 主要操作 | |
A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
C | Fe | I2 | / | 加热 |
D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
A.A
B.B
C.C
D.D


