题目内容
4.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟液态氨、乙醇等发生类似的反应,并都产生氢气.下列有关NaH的叙述错误的是( )| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中H-半径比Li+半径小 | |
| C. | NaH跟液氨反应时,有NaNH2生成 | |
| D. | Na原子与H原子结合组成NaH过程中发生了电子转移. |
分析 A.氧化还原反应中所含元素化合价降低的反应物为氧化剂;
B.具有相同核外电子排布的,原子序数越大,离子半径越小;
C.根据氢化钠和水反应生成物确定和液氨反应的生成物;
D.NaH是由钠离子与氢负离子通过离子键结合而成.
解答 解:A.反应NaH+H2O═NaOH+H2↑中,水中氢元素得电子化合价降低,所以水是氧化剂,故A正确;
B.氢离子和锂离子具有相同的电子层结构,锂原子序数大于氢原子序数,所以H-半径比Li+半径大,故B错误;
C.氢化钠和液氨反应方程式为NaH+H3N═NaNH2+H2↑,故C正确;
D.NaH为离子化合物,Na原子失去电子生成钠离子,氢原子得到电子生成氢负离子,二者通过离子键结合,故D正确;
故选:B.
点评 本题考查了氢化钠的性质,熟悉氧化还原反应规律及氢化钠结构是解题关键,题目难度不大.

练习册系列答案
相关题目
15.下列烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
| A. | C3H8 | B. | C4H10 | C. | C6H14 | D. | C8H18 |
12. 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜电极附近观察到黄绿色气体 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上发生还原反应 | D. | 溶液中的Na+向石墨电极移动 |
19.下列化学反应既属于氧化还原反应又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
9.下列物质中,只存在共价键的是( )
| A. | Ne | B. | NaOH | C. | CO2 | D. | Na2O |
16.己烯雌酚是人工合成的激素类药物,其结构如下.下列有关叙述不正确的是( )


| A. | 己烯雌酚的分子式为C18H20O2 | |
| B. | 己烯雌酚可与NaOH和NaHCO3发生反应 | |
| C. | 1 mol该有机物可以与5 mol Br2发生反应 | |
| D. | 该有机物最多可能有18个碳原子共面 |
13.已知核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中含质子的物质的量是( )
| A. | (A-N+2)mol | B. | $\frac{n(A-N+10)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+16}$mol | D. | $\frac{n(A-N+16)}{A}$mol |
14.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答题:
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
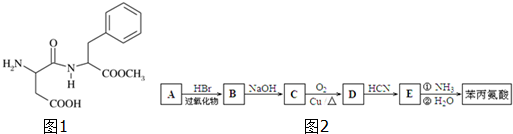
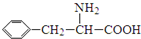 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示: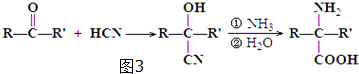
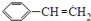 .
.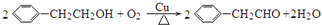 .
. .
.