题目内容
9. 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 | |
| C. | 装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶体带正电荷 | |
| D. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
分析 A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极;
B、甲装置中C电极上氢氧根离子放电,D电极上铜离子放电,E电极上氯离子放电,F电极上氢离子放电,根据得失电子和生成物的关系式计算;
C、电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动;
D、电镀时,镀层作阳极,镀件作阴极,电解质溶液中金属阳离子与阳极材料是相同的元素.
解答 解:A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;
B、甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故B正确;
C、丁装置中Y电极是阴极,如果Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,故C错误;
D、若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故D错误;
故选B.
点评 本题考查了电解池原理,能正确判断电解池的阴阳极是解本题的关键,明确电泳现象证明了胶粒带电.

练习册系列答案
相关题目
16.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究.
已知:①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+.
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的正极反应式为;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作965s.(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:
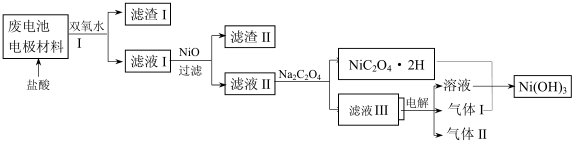
①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;,;将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).若两种沉淀都析出,pH应控制在不超过6.4(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
②滤液III中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解池阳极产生Cl2将NiC2O4氧化为Ni(OH)3.
已知:①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+.
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
(1)该电池的正极反应式为;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作965s.(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:

①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;,;将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).若两种沉淀都析出,pH应控制在不超过6.4(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
②滤液III中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解池阳极产生Cl2将NiC2O4氧化为Ni(OH)3.
14.下列说法正确的是( )
| A. | 常温下,pH均为9的CH3COONa和NaOH溶液中,水的电离程度相同 | |
| B. | 室温下,0.1mol•L-1氨水加水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| C. | 电解精炼铜过程中,阳极减少的质量与阴极增加的质量一定相等 | |
| D. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
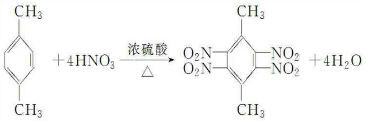
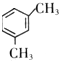
4.0.5mol某不饱和烃能与1molHCl完全加成,其加成后的产物又能被4molCl2完全取代.则该烃是( )
| A. | 乙炔 | B. | 丙烯 | C. | 丙炔 | D. | 1,3-丁二烯 |
1.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 乙酸和乙醇 | C. | 溴和四氯化碳 | D. | 水和四氯化碳 |
19.下列选用的试剂能达到对应实验目的是( )
| 实验目的 | 选用试剂 | |
| A | 检验FeCl2溶液是否变质 | KSCN溶液 |
| B | 除去氨气中的水蒸气 | 浓H2SO4 |
| C | 除去乙酸乙酯中的乙酸 | NaOH溶液 |
| D | 除去二氧化碳中少量的氯化氢气体 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |

 .
.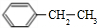 、
、 .
.