题目内容
如下图所示,甲池的总反应式为:N2H4+O2=N2+2H2O

下列关于该电池工作时说法正确的是
- A.甲池中负极反应为:N2H4-4e-=N2+4H+
- B.甲池溶液pH不变,乙池溶液pH减小
- C.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体
- D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D
试题分析:A、甲池中原电池反应,对应的电极反应式是:正极O2+4e-+2H2O=4OH-,负极N2H4-4e-+4OH-=N2+4H2O,错误;B、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,错误;C、说气体的体积没有说标况无法计算,错误;D、乙池发生的是电解池反应两极析出的分别是Cu和O2,因而加CuO后溶液能够复原,正确。
考点:考查原电池、电解池工作的基本原理,以及原电池电极反应式的书写。
试题分析:A、甲池中原电池反应,对应的电极反应式是:正极O2+4e-+2H2O=4OH-,负极N2H4-4e-+4OH-=N2+4H2O,错误;B、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,错误;C、说气体的体积没有说标况无法计算,错误;D、乙池发生的是电解池反应两极析出的分别是Cu和O2,因而加CuO后溶液能够复原,正确。
考点:考查原电池、电解池工作的基本原理,以及原电池电极反应式的书写。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题: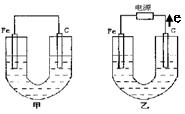
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)



