题目内容
经常有人因误食亚硝酸钠(NaNO2)而中毒,原因是NaNO2像食盐一样既有咸味,又有很强毒性.已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
(1)HI表现的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥表示电子转移的方向和数目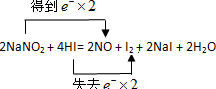

(3)当此反应中转移的电子数为2.408×1023时,被氧化的HI物质的量为
(1)HI表现的性质是
B
B
(填序号)A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥表示电子转移的方向和数目


(3)当此反应中转移的电子数为2.408×1023时,被氧化的HI物质的量为
0.4mol
0.4mol
.分析:(1)HI中I元素的化合价部分升高,部分不变,生成盐(NaI);
(2)N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,以此分析;
(3)由反应可知,2molHI被氧化时转移2mol电子,以此来计算.
(2)N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,以此分析;
(3)由反应可知,2molHI被氧化时转移2mol电子,以此来计算.
解答:解:(1)由2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,HI中I元素的化合价部分升高,部分不变,生成盐(NaI),则HI体现酸性和还原性,故答案为:B;
(2)N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,则双线桥表示电子转移的方向和数目为 ,
,
故答案为: ;
;
(3)由反应可知,2molHI被氧化时转移2mol电子,当此反应中转移的电子数为2.408×1023时,即转移0.4mol电子,则被氧化的HI的物质的量为0.4mol,故答案为:0.4mol.
(2)N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,则双线桥表示电子转移的方向和数目为
 ,
,故答案为:
 ;
;(3)由反应可知,2molHI被氧化时转移2mol电子,当此反应中转移的电子数为2.408×1023时,即转移0.4mol电子,则被氧化的HI的物质的量为0.4mol,故答案为:0.4mol.
点评:本题考查氧化还原反应及有关计算,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
