题目内容
(1)维生素C 又称“抗坏血酸”,在人体内有重要的功能.例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的
Fe2+,这说明维生素C 具有
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2K NO3+3C
=K2S+N2↑+3CO2↑.该反应的氧化剂是
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.上述反应中,若有10个铝原子参与反应,则转移的电子数为
Fe2+,这说明维生素C 具有
还原性
还原性
性.(填氧化性或还原性)(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2K NO3+3C
=K2S+N2↑+3CO2↑.该反应的氧化剂是
S、KNO3
S、KNO3
,当16g 硫参加反应时,转移的电子总数为6NA
6NA
.(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.上述反应中,若有10个铝原子参与反应,则转移的电子数为
30
30
个,用“双线桥法”标明反应中电子转移的方向和数目.分析:(1)维生素C能Fe3+转变为易吸收的Fe2+,反应中铁离子得电子作氧化剂,则维生素C作还原剂;
(2)得电子化合价降低的物质作氧化剂,根据硫和转移电子之间的关系式计算;
(3)根据铝和转移电子之间的关系式计算转移电子数,根据元素化合价变化标出反应中电子转移的方向和数目.
(2)得电子化合价降低的物质作氧化剂,根据硫和转移电子之间的关系式计算;
(3)根据铝和转移电子之间的关系式计算转移电子数,根据元素化合价变化标出反应中电子转移的方向和数目.
解答:解:(1)维生素C能Fe3+转变为易吸收的Fe2+,反应中铁离子得电子作氧化剂,则维生素C作还原剂,还原剂具有还原性,所以维生素C具有还原性,故答案为:还原性;
(2)反应S+2K NO3+3C=K2S+N2↑+3CO2↑中,硫元素化合价由0→-2价,N元素由+5价→0价,所以硫和硝酸钾得电子化合价降低作氧化剂,
S+2K NO3+3C=K2S+N2↑+3CO2↑ 转移电子
32g 12N A
16g 6NA
所以转移电子数是6NA,
故答案为:S、KNO3,6NA;
(3)根据铝和转移电子之间的关系式计算转移电子数,根据元素化合价变化标出反应中电子转移的方向和数目.
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O转移电子
10 30
10 30
所以若有10个铝原子参与反应,则转移的电子数为30,
该反应中铝失去电子数为10×3,NaNO3得到电子数为6×5,所以用“双线桥法”标明反应中电子转移的方向和数目为: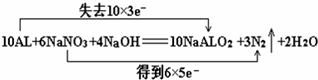 ,
,
故答案为: .
.
(2)反应S+2K NO3+3C=K2S+N2↑+3CO2↑中,硫元素化合价由0→-2价,N元素由+5价→0价,所以硫和硝酸钾得电子化合价降低作氧化剂,
S+2K NO3+3C=K2S+N2↑+3CO2↑ 转移电子
32g 12N A
16g 6NA
所以转移电子数是6NA,
故答案为:S、KNO3,6NA;
(3)根据铝和转移电子之间的关系式计算转移电子数,根据元素化合价变化标出反应中电子转移的方向和数目.
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O转移电子
10 30
10 30
所以若有10个铝原子参与反应,则转移的电子数为30,
该反应中铝失去电子数为10×3,NaNO3得到电子数为6×5,所以用“双线桥法”标明反应中电子转移的方向和数目为:
 ,
,故答案为:
 .
.点评:本题考查了氧化还原反应,难点是标出电子转移的方向和数目,明确元素的化合价是解本题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。 ② KI溶液 ③酸性KMnO4溶液
② KI溶液 ③酸性KMnO4溶液 ② KI ③ KIO3
② KI ③ KIO3