��Ŀ����
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ġ���֪��H2O��g��=H2O��l�� ��H1=��Q1kJ��mol��1
C2H5OH��g��=C2H5OH��l�� ��H2=��Q2kJ��mol��1
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g�� ��H3=��Q3kJ��mol��1
��ʹ23g�ƾ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ��kJ�� �� ��
A��Q1+ Q2+Q3 B��0��5��Q1+Q2+Q3 ��
C��0��5 Q2��1��5 Q1��0��5Q3 D��1��5 Q1��0��5 Q2+0��5Q3
���𰸡�
B
����������

��ϰ��ϵ�д�
�����Ŀ
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ģ�
��֪��H2O��g��=H2O��l����H1=-Q1kJ?mol-1��Q1��0��
C2H5OH��g��=C2H5OH��l����H2=-Q2kJ?mol-1��Q2��0��
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g����H3=-Q3kJ?mol-1��Q3��0��
��ʹ23gҺ̬�Ҵ���ȫȼ�գ����ָ������£���ų�������Ϊ��kJ����������
��֪��H2O��g��=H2O��l����H1=-Q1kJ?mol-1��Q1��0��
C2H5OH��g��=C2H5OH��l����H2=-Q2kJ?mol-1��Q2��0��
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g����H3=-Q3kJ?mol-1��Q3��0��
��ʹ23gҺ̬�Ҵ���ȫȼ�գ����ָ������£���ų�������Ϊ��kJ����������
| A��Q1+Q2+Q3 | B��0.5��Q1+Q2+Q3�� | C��0.5 Q1-1.5 Q2+0.5Q3 | D��1.5 Q1-0.5 Q2+0.5Q3 |
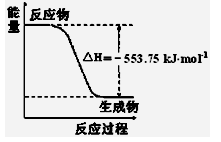
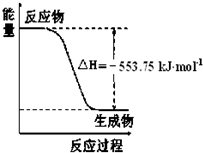 ��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���
��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���