题目内容
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(SO2)随时间的变化如表:
则下列说法正确的是( )
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A、当v(SO2)=v(SO3)时,说明该反应已达到平衡状态 |
| B、用O2表示0~4min内该反应的平均速率为0.005mol/(L?min) |
| C、若升高温度,则SO2的反应速率会变大,平衡常数K值会增大 |
| D、平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大 |
分析:A.同一物质的正逆反应速率相等时,该反应达到平衡状态;
B.根据c=
计算二氧化硫的反应速率,再根据同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比计算氧气的平均反应速率;
C.升高温度,化学平衡向吸热反应方向移动;
D.平衡时,再通入氧气,平衡向正反应方向移动,但氧气的转化率减小.
B.根据c=
| ||
| △t |
C.升高温度,化学平衡向吸热反应方向移动;
D.平衡时,再通入氧气,平衡向正反应方向移动,但氧气的转化率减小.
解答:解:A.当v(SO2)=v(SO3)时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物的物质的量及转化率有关,故A错误;
B.0~4min内二氧化硫的平均反应速率=
=0.015mol/(L?min),同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,则用O2表示0~4min内该反应的平均速率为0.0075mol/(L?min),故B错误;
C.升高温度,虽然反应速率增大,但平衡向逆反应方向移动,导致化学平衡常数减小,故C错误;
D.平衡时,再通入氧气,平衡向正反应方向移动,导致二氧化硫的转化率增大,温度不变,化学平衡常数不变,导致氧气的转化率减小,故D正确;
故选D.
B.0~4min内二氧化硫的平均反应速率=
| ||
| 4min |
C.升高温度,虽然反应速率增大,但平衡向逆反应方向移动,导致化学平衡常数减小,故C错误;
D.平衡时,再通入氧气,平衡向正反应方向移动,导致二氧化硫的转化率增大,温度不变,化学平衡常数不变,导致氧气的转化率减小,故D正确;
故选D.
点评:本题考查了化学平衡过程的建立,根据反应速率公式、化学平衡移动的影响因素来分析解答即可,化学平衡是考试热点,也是学习难点,常常考查化学平衡常数的计算、化学平衡或化学反应速率图象等知识点,注意化学平衡状态的判断方法,难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目

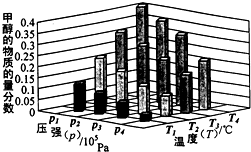 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.

