题目内容
|
把NaOH溶液和硫酸铜溶液加入某病人的尿液中,微热时如果观察到红色沉淀,说明尿液中含有 | |
A. |
食醋 |
B. |
白酒 |
C. |
食盐 |
D. |
葡萄糖 |
答案:D

练习册系列答案
相关题目
下列除去杂质所用的方法正确的是( )
| A、除去SO2气体中的少量HCl:把混合气体依次通过NaOH溶液和浓硫酸 | B、除去NaHCO3溶液中少量Na2CO3:向溶液中通入过量的CO2 | C、除去NaHCO3固体中少量Na2CO3粉末:把固体置于坩埚中充分加热 | D、除去CaCO3中少量CaO:把固体置于坩埚中充分灼烧 |
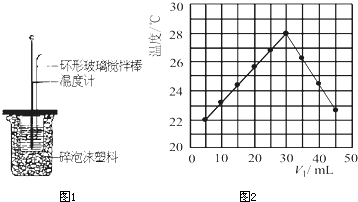
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫 酸溶液进行中和热的测定。
酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)简述称量NaOH固体的操作过程:
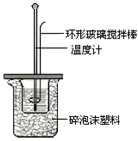
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[来源:学科网ZXXK] | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度


 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.