题目内容
根据下列实验现象,所得结论正确的是( )
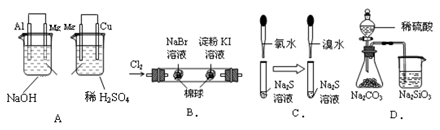

| 实验 | 实验现象 | 结论 |
| A. | 左烧杯中镁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Mg>Cu |
| B. | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C. | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
| D. | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
D
A选项结论不正确;金属活动性仍然是:Mg>Al>Cu。虽然在 该原电池中镁表面有气泡属于原电池的正极,AL属于负极,但活动性还是Mg>Al,造成这种现象的原因是,只有AL才能与NaOH溶液反应,而镁不能与NaOH溶液反应。所以,一般,我们在判断原电池的正、负时不能一概而论地说活性强的金属一定是属于原电池的负极,还要结合电解质溶液。
该原电池中镁表面有气泡属于原电池的正极,AL属于负极,但活动性还是Mg>Al,造成这种现象的原因是,只有AL才能与NaOH溶液反应,而镁不能与NaOH溶液反应。所以,一般,我们在判断原电池的正、负时不能一概而论地说活性强的金属一定是属于原电池的负极,还要结合电解质溶液。
B选项左边棉花变为橙色是发生了反应:CL2 + 2NaBr == 2NaCL + Br2;说明氧化性:Cl2>Br2。右边棉花变为蓝色可能发生的反应:CL2 + 2KI== 2KCL + I2:也可能发生的反应:Br2 + 2KI== 2KBr + I2:不能得出Br2>I2的结论。
C选项只能得出氧化性:Cl2>S:Br2>S而得不到氧化性:Cl2>Br2
D选项正确;锥形瓶中有气体产生,烧杯中液体变浑浊说明:酸性:H2SO4>H2CO3>H2SiO3;对于非金属元素来说,最高价氧化物对应的水化物—酸性越强则非金属越强。
 该原电池中镁表面有气泡属于原电池的正极,AL属于负极,但活动性还是Mg>Al,造成这种现象的原因是,只有AL才能与NaOH溶液反应,而镁不能与NaOH溶液反应。所以,一般,我们在判断原电池的正、负时不能一概而论地说活性强的金属一定是属于原电池的负极,还要结合电解质溶液。
该原电池中镁表面有气泡属于原电池的正极,AL属于负极,但活动性还是Mg>Al,造成这种现象的原因是,只有AL才能与NaOH溶液反应,而镁不能与NaOH溶液反应。所以,一般,我们在判断原电池的正、负时不能一概而论地说活性强的金属一定是属于原电池的负极,还要结合电解质溶液。B选项左边棉花变为橙色是发生了反应:CL2 + 2NaBr == 2NaCL + Br2;说明氧化性:Cl2>Br2。右边棉花变为蓝色可能发生的反应:CL2 + 2KI== 2KCL + I2:也可能发生的反应:Br2 + 2KI== 2KBr + I2:不能得出Br2>I2的结论。
C选项只能得出氧化性:Cl2>S:Br2>S而得不到氧化性:Cl2>Br2
D选项正确;锥形瓶中有气体产生,烧杯中液体变浑浊说明:酸性:H2SO4>H2CO3>H2SiO3;对于非金属元素来说,最高价氧化物对应的水化物—酸性越强则非金属越强。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



 CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。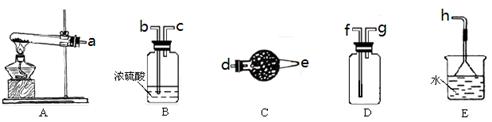
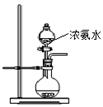
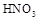 中,吸取适量的
中,吸取适量的 稀
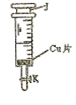
稀 ,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。 学方程式并配以必要的文字说明)。
学方程式并配以必要的文字说明)。

 适量的蒸馏水使它溶解并恢复至室温。
适量的蒸馏水使它溶解并恢复至室温。 不慎超过了刻度线 d.砝码上沾有杂质(或者使用生锈的砝码)
不慎超过了刻度线 d.砝码上沾有杂质(或者使用生锈的砝码)