题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B.1L、0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA个
C.标准状况下,22.4LHF含NA个分子
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
【答案】A
【解析】
A. S8分子结构:![]() ,1个分子含有8个共价键, 32 g S8物质的量为0.125mol,因此32 g S8中的共价键数目为NA,故A正确;
,1个分子含有8个共价键, 32 g S8物质的量为0.125mol,因此32 g S8中的共价键数目为NA,故A正确;
B. 1L、0.1 molL1的Na2CO3溶液中碳酸根物质的量为0.1mol,碳酸根水解生成碳酸氢根和氢氧根,因此溶液中含阴离子总数大于0.1NA个,故B错误;
C. HF在标准状况下是非气态的物质,无法计算物质的量,故C错误;
D. 标准状况下,11.2 L Cl2物质的量为0.5mol,0.5mol Cl2 溶于水是可逆反应,因此溶液中Cl-、ClO-和HClO的微粒数之和小于NA,故D错误。
综上所述,答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
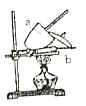
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
【题目】![]() 分解速率受多种因素影响。实验测得
分解速率受多种因素影响。实验测得![]() 时不同条件下
时不同条件下![]() 浓度随时间的变化如图所示
浓度随时间的变化如图所示![]() 起始浓度均为
起始浓度均为![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
实验条件 |
|
|
|
① | 0 | 0 | |
② |
| 0 | |
③ |
| 3 | |
④ |
| 3 |
A.![]() 内,④条件下
内,④条件下![]() 的平均反应速率为
的平均反应速率为![]()
B.分析②③条件可知,![]() 浓度越大,
浓度越大,![]() 分解速率越慢
分解速率越慢
C.少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.分析①②条件可知,无![]() 时,碱性条件有利于双氧水的分解
时,碱性条件有利于双氧水的分解