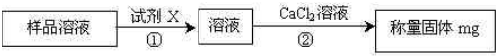
题目内容
某CaCl2样品中可能混有FeCl3、MgCl2、NaCl和Na2CO3中的一种或两种杂质,取11.1 g样品溶解,得无色溶液,再加入足量AgNO3溶液,得29.7 g沉淀。由此可知,样品所含杂质的正确结论是( )A.一定无Na2CO3,可能有MgCl2
B.一定有FeCl3,可能有NaCl
C.一定有MgCl2,可能有NaCl
D.一定有NaCl
C
解析:原样品溶于水形成无色溶液,可排除FeCl3与Na2CO3的存在。因Fe3+的溶液显黄色,Na2CO3存在时会与CaCl2反应形成CaCO3沉淀。假设原样品全部为CaCl2,则可形成AgCl沉淀的质量为:
CaCl2 — 2AgCl
111 2×143.5
11.1 g m(AgCl)
m(AgCl)=![]() =28.7 g<29.7 g(实际得到沉淀量)。这说明CaCl2样品中一定含有比CaCl2含氯质量分数更高的物质,即MgCl2(比较含氯量时,只要分析Ca、Mg的相对原子质量即可),但样品中是否含有含氯量较CaCl2低的NaCl(可转化成Na2Cl2比较)却不能确定。故正确答案为C项。
=28.7 g<29.7 g(实际得到沉淀量)。这说明CaCl2样品中一定含有比CaCl2含氯质量分数更高的物质,即MgCl2(比较含氯量时,只要分析Ca、Mg的相对原子质量即可),但样品中是否含有含氯量较CaCl2低的NaCl(可转化成Na2Cl2比较)却不能确定。故正确答案为C项。

练习册系列答案
相关题目
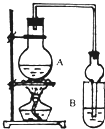 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
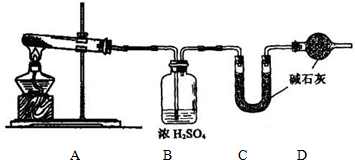
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示: