题目内容
已知下列热化学方程式
CH4(g)+2O2(g)══CO2(g)+2H2O(1) △H=-890.3 kJ/mol
2H2(g)+O2(g)══2H2O(1) △H=-571.6 kJ/mol
现有H2跟CH4的混合气体5mol,测得这些混合气体完全燃烧共放出3242.5kJ/mol热量,由此可知混合气体中CH4跟H2的体积比是( )
A.1︰3 B.2︰3 C.3︰2 D.1︰1
答案:C
提示:
提示:
设CH4为xmol,则H2为(5-x)mol,所以890.3x+285.8×(5-x)=3242.5
|

练习册系列答案
相关题目
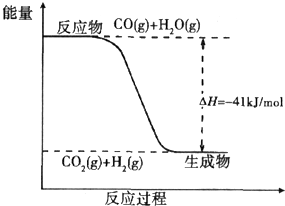 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.