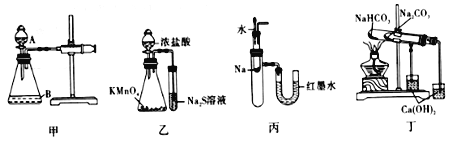
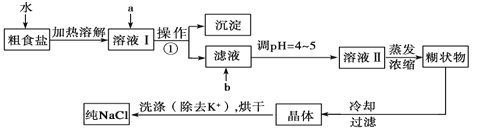
��Ŀ����
����Ŀ��ͬ��ͬѹ�£��������г���35Cl2���������г���37Cl2��������������ȷ������ ��
A�����������������ȣ��ס�����������������ܶ�֮��Ϊ35��37
B�����������������ȣ��ס��������������������֮��Ϊ35��37
C������������������ȣ��ס�������������������������֮��Ϊ37��35
D�����������������ȣ��ס�������������������������֮��Ϊ9��10
���𰸡�B
��������
��������� 35Cl2����Է�������Ϊ70��37Cl2����Է�������Ϊ74��A�����������������ȣ�n=![]() =
=![]() �ɵ���=
�ɵ���=![]() =
=![]() ���ܶ���Ħ�����������ȣ��ס�����������������ܶ�֮��Ϊ35��37����A��ȷ��B����n=
���ܶ���Ħ�����������ȣ��ס�����������������ܶ�֮��Ϊ35��37����A��ȷ��B����n= ![]() =
= ![]() ��֪���������������ȣ����������������ȣ��ס��������������������֮��Ϊ1��1����B����C������������������ȣ���n=
��֪���������������ȣ����������������ȣ��ס��������������������֮��Ϊ1��1����B����C������������������ȣ���n= ![]() ��֪����������ʵ�����Ħ�������ʷ��ȣ���ס�������������������ʵ���֮��Ϊ37��35������ClԪ����ɣ�������������֮��Ϊ37��35����C��ȷ��D�����������������ȣ���������������������ʵ�����ȣ��ס�������������������������֮��Ϊ��35-17����2����37-17����2=9��10����D��ȷ����ѡB��
��֪����������ʵ�����Ħ�������ʷ��ȣ���ס�������������������ʵ���֮��Ϊ37��35������ClԪ����ɣ�������������֮��Ϊ37��35����C��ȷ��D�����������������ȣ���������������������ʵ�����ȣ��ס�������������������������֮��Ϊ��35-17����2����37-17����2=9��10����D��ȷ����ѡB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�