题目内容
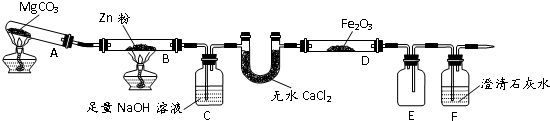
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1)MgCO3的分解产物为______.
(2)装置C的作用是______,处理尾气的方法为______.
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为______.
③乙组步骤4中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______.
④从实验安全考虑,题9图装置还可采取的改进措施是______.
(2)结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;CO气体不一定完全反应,因此尾气中会有CO,可利用其可燃性采取点燃法来进行尾气处理.故答案为:除CO2 点燃.
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
②利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
③因Fe3+遇SCN-显红色,所以步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;
④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置B C之间添加装置E防倒吸.
故答案为:①Fe ②Fe3O4+8H+=Fe2++2Fe3++4H2O③Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色;假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立
分析:(1)难溶的碳酸盐受热易分解为氧化物和CO2;
(2)CO2与Zn作用生成CO气体,装置C中NaOH是用来吸收CO中混有的CO2气体;尾气中CO,可利用其可燃性采取点燃法来进行尾气处理;
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
②Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
③步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;
④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂.
点评:本题结合实验考查了尾气处理,防倒吸,以及Fe和Fe的化合物的性质,综合性较强,注意实验过程中前后联系.

 名校课堂系列答案
名校课堂系列答案某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)

题9图
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
|
步骤 |
操作 |
甲组现象 |
乙组现象 |
|
1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
|
2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
|
3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
|
4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 ;
④从实验安全考虑,题9图装置还可采取的改进措施是 。