题目内容
【题目】下列有关溶液中粒子浓度的关系式中,正确的是
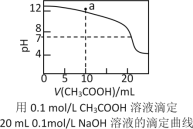
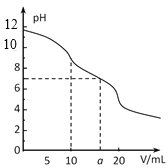
A.pH相同的①CH3COONa、②NaHCO3、③![]() 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.如图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
【答案】D
【解析】
A.从三种钠盐对应的酸的强弱来看,CH3COOH>H2CO3>C6H5OH,所以相同浓度的三种钠盐pH的大小是C6H5ON>NaHCO3>CH3COONa,所以pH相同的三份钠盐中c(Na+)浓度①>②>③,故A错误;
B.据从化学式NaHA可以看出,Na原子应与A原子的个数相等,即物料守恒,所以应该为c(Na+)=c (A2-)+c(HA-)+c(H2A) ,故B错误;
C.电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),pH=7时,溶液呈中性,此溶液中必有c(Na+)=c(CH3COO-),故C错误;
D.a点时加入NaOH的量为l0mL,所得溶液相当于CH3COONa和NaOH物质的量1﹕1混合所得的溶液。据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),据物料守恒有c(Na+)=2c(CH3COO-)+2c(CH3COOH),两式相减即得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下表中实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 | 测得pH=3.2 | NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
D | 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色ZnS沉淀,后产生黑色CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D