题目内容
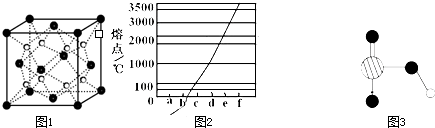
如图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.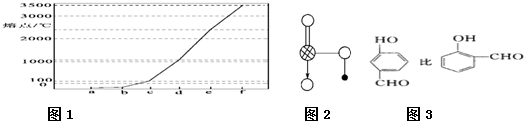
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含
(2)a与b的元素形成的10电子中性分子X的空间构型为
(3)如图2是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因
(4)氢键的形成对物质的性质具有一定的影响.沸点

(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含
3
3
σ键和2
2
个π键.(2)a与b的元素形成的10电子中性分子X的空间构型为
三角锥形
三角锥形
;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为[Ag(NH3)2]+
[Ag(NH3)2]+
,其中X与Ag+之间以配位
配位
键结合.(3)如图2是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因
HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中
HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中
.(4)氢键的形成对物质的性质具有一定的影响.沸点
高
高
.(填高或低)分析:(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH;
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,能以配位键形成银氨络离子;
(3)由图可知为硝酸的结构,含有-OH易形成氢键;
(4)氢键主要影响物质的熔沸点.
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,能以配位键形成银氨络离子;
(3)由图可知为硝酸的结构,含有-OH易形成氢键;
(4)氢键主要影响物质的熔沸点.
解答:解:(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH,则含2个C-Hσ键和1个C-Cσ键和2个π键,
故答案为:3;2;
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,空间结构为三角锥形,能以配位键形成银氨络离子,其化学式为[Ag(NH3)2]+,
故答案为:三角锥形;[Ag(NH3)2]+;配位;
(3)由图可知为硝酸的结构,含有-OH易与水分子之间形成氢键,且HNO3是极性分子,易溶于极性的水中,则易溶于水,
故答案为:HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中;
(4)氢键主要影响物质的熔沸点,使含氢键的物质的沸点高,故答案为:高.
故答案为:3;2;
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,空间结构为三角锥形,能以配位键形成银氨络离子,其化学式为[Ag(NH3)2]+,
故答案为:三角锥形;[Ag(NH3)2]+;配位;
(3)由图可知为硝酸的结构,含有-OH易与水分子之间形成氢键,且HNO3是极性分子,易溶于极性的水中,则易溶于水,
故答案为:HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中;
(4)氢键主要影响物质的熔沸点,使含氢键的物质的沸点高,故答案为:高.
点评:本题考查知识点较多,涉及物质熔点的比较、化学键、溶解性、氢键对物质沸点的影响等,题目难度中等,(2)为解答的易错点和难点.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 (1)0.1mol/LNa2CO3溶液呈
(1)0.1mol/LNa2CO3溶液呈