题目内容
A、B、C、D、E、F、G、H、和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,Ⅰ能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白烟
③B和E都能使品红溶液褪色
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O
⑧将B和H 在瓶中混合后于光亮处放置几分钟,瓶内壁出现油状液滴并产生A.
回答下列问题:
(1)A的化学式是 ,②中白烟的化学式是 ;
(2)④中发生反应的化学方程式是 ;
(3)⑤中发生反应的化学方程式是 ;
(4)C的化学式是 ,D的电子式是 ;
(5)⑦中发生反应的化学方程式是 ;
(6)H的结构式是 .
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,Ⅰ能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白烟
③B和E都能使品红溶液褪色
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O
⑧将B和H 在瓶中混合后于光亮处放置几分钟,瓶内壁出现油状液滴并产生A.
回答下列问题:
(1)A的化学式是
(2)④中发生反应的化学方程式是
(3)⑤中发生反应的化学方程式是
(4)C的化学式是
(5)⑦中发生反应的化学方程式是
(6)H的结构式是
考点:无机物的推断
专题:推断题
分析:①Ⅰ能使湿润的红色石蕊试纸变蓝,为NH3;
②A和I相遇产生白烟,为NH3与HCl,则A为HCl,生成白烟为NH4Cl;
③B和E都能使品红溶液褪色,为Cl2和SO2;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟,故B为Cl2,E为SO2;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物,F为CO2;
⑥C和D相遇生成红棕色气体,为NO和O2;
⑦G在D中燃烧可以产生E和H2O,E为SO2,故D为O2,故C为NO,G含有H、S两种元素,G为H2S;
⑧B为Cl2,和H在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A(HCl),故H为CH4,以此解答该题.
②A和I相遇产生白烟,为NH3与HCl,则A为HCl,生成白烟为NH4Cl;
③B和E都能使品红溶液褪色,为Cl2和SO2;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟,故B为Cl2,E为SO2;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物,F为CO2;
⑥C和D相遇生成红棕色气体,为NO和O2;
⑦G在D中燃烧可以产生E和H2O,E为SO2,故D为O2,故C为NO,G含有H、S两种元素,G为H2S;
⑧B为Cl2,和H在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A(HCl),故H为CH4,以此解答该题.
解答:
解:①Ⅰ能使湿润的红色石蕊试纸变蓝,为NH3;
②A和I相遇产生白烟,为NH3与HCl,则A为HCl,生成白烟为NH4Cl;
③B和E都能使品红溶液褪色,为Cl2和SO2;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟,故B为Cl2,E为SO2;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物,F为CO2;
⑥C和D相遇生成红棕色气体,为NO和O2;
⑦G在D中燃烧可以产生E和H2O,E为SO2,故D为O2,故C为NO,G含有H、S两种元素,G为H2S;
⑧B为Cl2,和H在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A(HCl),故H为CH4,
(1)由以上分析可知A为HCl,②中白烟的化学式是NH4Cl,故答案为:HCl;NH4Cl;
(2)④中发生反应为铜和氯气的反应,化学方程式是Cu+Cl2
CuCl2,
故答案为:Cu+Cl2
CuCl2;
(3)⑤为镁在二氧化碳中的燃烧,发生反应的化学方程式是2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
(4)C为NO,D为O2,电子式为 ,故答案为:NO;
,故答案为:NO; ;
;
(5)⑦中发生反应的化学方程式是2H2S+3O2
2H2O+2SO2,故答案为:2H2S+3O2
2H2O+2SO2;
(6)H为CH4,结构式为 ,故答案为:
,故答案为: .
.
②A和I相遇产生白烟,为NH3与HCl,则A为HCl,生成白烟为NH4Cl;
③B和E都能使品红溶液褪色,为Cl2和SO2;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟,故B为Cl2,E为SO2;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物,F为CO2;
⑥C和D相遇生成红棕色气体,为NO和O2;
⑦G在D中燃烧可以产生E和H2O,E为SO2,故D为O2,故C为NO,G含有H、S两种元素,G为H2S;
⑧B为Cl2,和H在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A(HCl),故H为CH4,
(1)由以上分析可知A为HCl,②中白烟的化学式是NH4Cl,故答案为:HCl;NH4Cl;
(2)④中发生反应为铜和氯气的反应,化学方程式是Cu+Cl2
| ||
故答案为:Cu+Cl2
| ||
(3)⑤为镁在二氧化碳中的燃烧,发生反应的化学方程式是2Mg+CO2
| ||
| ||
(4)C为NO,D为O2,电子式为
 ,故答案为:NO;
,故答案为:NO; ;
;(5)⑦中发生反应的化学方程式是2H2S+3O2
| ||
| ||
(6)H为CH4,结构式为
 ,故答案为:
,故答案为: .
.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质,本题以文字描述形式考查中学常见气体的性质、常用化学用语的书写,难度不大,注意基础知识的掌握,注意Mg可以在二氧化碳和氮气中燃烧.

练习册系列答案
相关题目
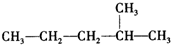 :
: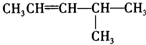 :
: :
: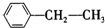 :
:
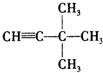
 烃被看作有机物的母体,请完成下列与烃的知识相关的练习:
烃被看作有机物的母体,请完成下列与烃的知识相关的练习: )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯