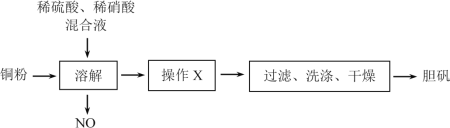
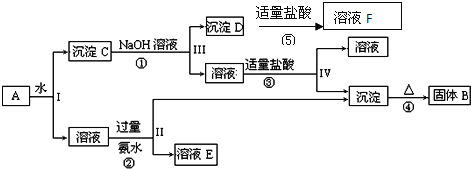
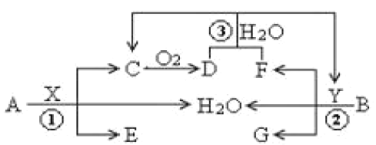
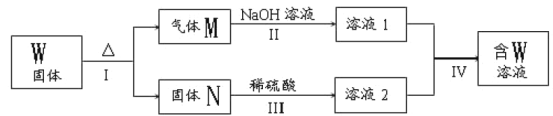
题目内容
【题目】在反应 3Cl2+6KOH![]() KClO3+5KCl+3H2O 中,下列说法正确的是:( )
KClO3+5KCl+3H2O 中,下列说法正确的是:( )
①Cl2是氧化剂,KOH是还原剂 ②KCl是还原产物,KClO3是氧化产物 ③反应中每消耗3 mol Cl2分子中有5mol 电子发生转移 ④被氧化与被还原的氯原子物质的量之比为5∶1
A.①④B.②③C.②③④D.②④
【答案】B
【解析】
3Cl2+6KOH![]() KClO3+5KCl+3H2O 中Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,据此分析解答。
KClO3+5KCl+3H2O 中Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,据此分析解答。
①只有Cl元素的化合价变化,Cl2是氧化剂,也是还原剂,故①错误;
②Cl元素化合价升高被氧化,则KClO3是氧化产物,而Cl元素化合价降低被还原,KCl是还原产物,故②正确;
③由Cl元素的化合价变化可知反应中每3个Cl2分子中有5个电子转移,故③正确;
④氯气中的氯由0价变成+5价,化合价升高被氧化;由0价变成-1价,化合价降低被还原,所以被氧化与被还原的氯原子的物质的量之比为1∶5,故④错误;
正确的有②③,故选B。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(1)能说明该反应已达到平衡状态的标志是___(填字母序号)
a.反应速率4v正(NH3)=5v逆(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内压强不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(2)某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为____(选填字母)。

(3)一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率____。在第5s时,NO2的转化率为____。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是___。
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
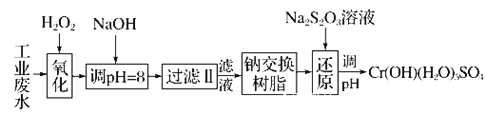
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。