题目内容
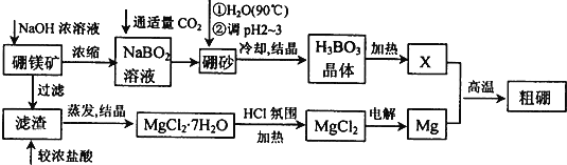
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

【答案】1s22s22p63s23p63d10或[Ar] 3d10小于NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小sp杂化、sp2杂化B(OH)3+ H2O ![]() [B(OH)4]-+H+
[B(OH)4]-+H+![]() CaC2 H2O C2H2CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2464×4/(a2b×10-21NA)(或者NA用6.02×1023表示)
CaC2 H2O C2H2CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2464×4/(a2b×10-21NA)(或者NA用6.02×1023表示)
【解析】
原子序数小于36的X、Y、Z、W、Q、R五种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,则X是H元素、Q是O元素,甲是H2O、乙是H2O2;Y原子核外电子占据3个轨道,则Y为B;Z是形成化合物种类最多的元素,为C元素;R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同,则E是Ca元素。
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去最外层1个电子生成Cu+,根据构造原理书写Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar] 3d10;NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小;
(2)Z2X2是C2H2,Z2X2与XZW反应可得丙烯腈![]() 则 XZW为HCN,HCN分子中C原子价层电子对个数是2且不含孤电子对,所以C原子杂化类型sp杂化,丙烯腈分子中亚甲基C原子价层电子对个数是3,杂化类型是sp2杂化,剩余两个C原子价层电子对个数是2,所以C原子杂化类型sp杂化;
则 XZW为HCN,HCN分子中C原子价层电子对个数是2且不含孤电子对,所以C原子杂化类型sp杂化,丙烯腈分子中亚甲基C原子价层电子对个数是3,杂化类型是sp2杂化,剩余两个C原子价层电子对个数是2,所以C原子杂化类型sp杂化;
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,则Y(OH)3为B(OH)3
电离方程式为:B(OH)3+ H2O ![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
(4)CaC2中C22-与O22+互为等电子体,等电子体原子个数相同、电子数相同、结构相似,所以O22+的电子式为![]() ;
;
(5)Z2X2为C2H2、X2Q 为H2O、RZ2 为CaC2,CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2 ,故沸点由高到低的顺序为:CaC2 >H2O >C2H2;
(6)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm, CaC2晶体中,阳离子的配位数为4,该晶胞中Ca2+个数![]() 、C22-个数
、C22-个数![]() ,其密度
,其密度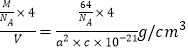 。
。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
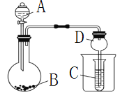
一课一练一本通系列答案【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D