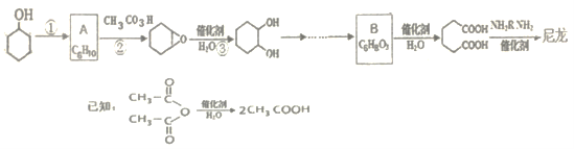
题目内容
【题目】由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐称为复盐。为确定某复盐结晶水合物Q(含有两种金属阳离子)的组成,甲、乙两位同学分别进行了如下实验:
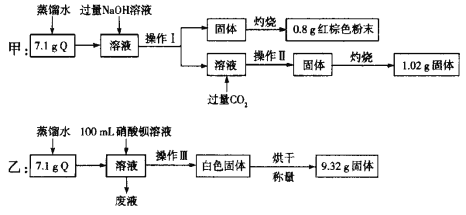
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为__________、洗涤,仅由甲的实验能不能确定操作Ⅰ中所得固体的成分?__________(填“能”或“不能”),说明理由:_________。
(2)甲实验中通入过量二氧化碳发生反应生成沉淀的离子方程式为_______。
(3)0.8 g红棕色粉末的物质的量为__________。
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,则硝酸钡溶液的物质的量浓度为__________。
(5)Q的化学式为________。
【答案】过滤 不能 ![]() 、
、![]() 在空气中灼烧时均能生成
在空气中灼烧时均能生成![]()
![]() 0.005 mol
0.005 mol ![]()
![]()
【解析】
甲的流程:溶液加入过量氢氧化钠溶液,生成偏铝酸钠和氢氧化铁(或氢氧化亚铁)沉淀,过滤、洗涤,沉淀灼烧得到氧化铁;溶液通入过量二氧化碳,发生反应CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,过滤、洗涤、灼烧得到氧化铝。由红棕色固体Fe2O3可知Q中含有![]() 或
或![]() ,铁元素的物质的量为
,铁元素的物质的量为![]() =0.01mol,质量为0.01mol×56g/mol=0.56g;由Q与过量氢氧化钠溶液反应得到的溶液中通入过量的二氧化碳后有沉淀Al(OH)3生成,氢氧化铝灼烧生成三氧化二铝,铝元素的物质的量为
=0.01mol,质量为0.01mol×56g/mol=0.56g;由Q与过量氢氧化钠溶液反应得到的溶液中通入过量的二氧化碳后有沉淀Al(OH)3生成,氢氧化铝灼烧生成三氧化二铝,铝元素的物质的量为![]() =0.02mol,质量为0.02mol×27g/mol=0.54g。
=0.02mol,质量为0.02mol×27g/mol=0.54g。
乙的流程:溶液中加入硝酸钡溶液,生成硫酸钡沉淀,过滤洗涤干燥得到9.32g的硫酸钡。硫酸根离子的物质的量为![]() =0.04mol,质量为0.04mol×96g/mol=3.84g;结晶水的质量为7.1g-3.84g-0.54g-0.56g=2.16g,物质的量为
=0.04mol,质量为0.04mol×96g/mol=3.84g;结晶水的质量为7.1g-3.84g-0.54g-0.56g=2.16g,物质的量为![]() =0.12mol;据此分析。
=0.12mol;据此分析。
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为过滤、洗涤,仅由甲的实验不能确定操作Ⅰ中所得固体,因为Fe(OH)2、Fe(OH)3在空气中灼烧时均能生成Fe2O3,无法确定是亚铁离子还是铁离子;
答案: 过滤 不能 Fe(OH)2、Fe(OH)3在空气中灼烧时均能生成Fe2O3
(2)甲实验中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,发生反应的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
答案:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
(3)0.8 g红棕色粉末(Fe2O3)的物质的量为![]() =0.005mol;
=0.005mol;
答案:0.005mol
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,Ba2++SO42-=BaSO4↓。硫酸根离子的物质的量为![]() =0.04mol,则硝酸钡溶液的物质的量浓度为
=0.04mol,则硝酸钡溶液的物质的量浓度为![]() =0.4mol/L;
=0.4mol/L;
答案:![]()
(5)Q晶体中Al3+的物质的量为0.02mol、Fe元素的物质的量为0.01mol、SO42-的物质的量为0.04mol、H2O的物质的量为0.12mol,物质的量之比为2:1:4:12,故其化学式为Al2Fe (SO4)4 12H2O;
答案:Al2Fe (SO4)4 12H2O

 阅读快车系列答案
阅读快车系列答案